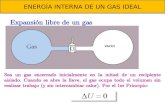
1 ecuacion de un gas ideal
Click here to load reader
-
Upload
liceo-nacional -
Category
Education
-
view
642 -
download
0
Transcript of 1 ecuacion de un gas ideal

Ecuación de estado de un gas
Las propiedades de un gas se describen mediante las variables V (volumen), T (Temperatura) y P (presión).
La ecuación que describe que interrelaciona estas cantidades se llama ecuación de estado.

Masa y molesEl número de moles de una masa de gas m, se puede calcular por
n = m/M
Donde M es la masa molar de la sustancia (g/mol)
Ejemplo:
400 g de oxígeno contienen:
n = 400/32 = 12.5 moles
El número total de moléculas en un recipiente, N, se puede expresar en término del número de moles, n, en la siguiente forma:
N = nNA
Ejemplo:
12.5 moles de oxígeno contienen:
N = nNA = 12.5 x 6.022 x 1023. = 7.5275 x 1024 moléculas

Variables termodinámicas
Las variables
P – presión
T – temperatura
V – volumen
n – número de moles
que se usan para describir sistemas térmicos, se llaman variables termodinámicas.

Ley de Boyle
La ley de Boyle establece que para T constante la presión de un gas es inversamente proporcional a su volumen.
constante=n
pV
p p
p1, V1 p2, V2
p2 > p1, V2 < V1

Ejemplo
En el cilindro de un automóvil la mezcla de aire y combustible se comprime de 0.23 L a 0.05 L, si la presión inicial es la presión atmosférica ¿cuál es la presión final?

Ley de Charles
La ley de Charles y Gay-Lussac establece que cuando la presión es constante el volumen es proporcional a la temperatura
V = constante T
V1
T1
V2 > V1
T2 > T1

Ley del gas ideal
Podemos combinar la ley de Charles y Gay-Lussac con la ley de Boyle, y obtenemos la ley del gas ideal:
pV = nRT
pV = NRT/NA = NkBT
R ≅ 8.314 N m/mol K = 8.314 J/mol K kB = 1.38 x 10–25 J/K
Constante de los gases Constante de Boltzman

ejemploUn gas ideal de 100 cm3 a 20°C y 100 Pa. Determine el número de moles de moles de gas en el recipiente y el número de moléculas.
El volumen en m3 es:
V = (100cm3)(1x10–6m3/cm3) = 1x10–4m3
El número de moles es:
n = PV/RT = (100)(0.0001)/((8.315)(293))
= 4x10–6 mol
N = nNA = 2.4 x 1018 moléculas

ejemplo
Un tanque de buzo de 10 L (0.35 pies3) a 22°C se llena con 66 pies3 de aire a 3000 lb/pulg2, ¿cuál es su temperatura cuando se llena completamente?
2
22
1
11
TVP
TVP =
P1 = 1 atm = 14.7 lb/pulg2, V1 = 0.35 pies3, T1 = 22°C = 295K, P2 = 3000 lb/pulg2, V2 = V1. Sustituyendo
T2 = 319K = 45.9 °C = 115 °F

Tarea
Un tanque que tiene un volumen de 0.100 m3 contiene gas helio a 150 atm. ¿Cuántos globos puede inflar el tanque si cada globo lleno es una esfera de 0.300 m de diámetro a una presión de absoluta de 1.20 atm?

ejemplo
La llanta de un automóvil se infla usando aire originalmente a 10°C y presión atmosférica normal. Durante el proceso el aire se comprime hasta 28% de su volumen original y su temperatura aumenta a 40°C. a) ¿cuál es la presión de la llanta? B) Después de que carro se maneja a alta rapidez, la temperatura del aire dentro de la llanta se eleva a 85°C y su volumen interior aumenta 2%. ¿Cuál es la nueva presión (absoluta) de la llanta en pascales?

TareaEn sistemas de vació con la tecnología más avanzada se logran presiones tan bajas como 10–9 Pa. Calcule el número de moléculas en un recipiente de 1.00 m3 a esta presión si la temperatura es de 27°C.

Los diagramas de fases indican las diversas fases de un material, como las del agua, que se ve aquí; líquido, sólido (hielo) y gas (vapor).
La intersección de las tres fronteras es el punto triple.