Aminas
-
Upload
angelik-moreno -
Category
Documents
-
view
5.552 -
download
5
Transcript of Aminas

AMINAS Enviado por german el Mié, 16/09/2009 - 00:30.
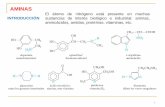
Nomenclatura de aminas
Se nombran sustituyendo la terminación -o del alcano por -amina (etanamina).
Propiedades físicas de aminas
Son compuestos con geometría piramidal. Presentan quiralidad aunque se encuentran en forma
de racematos. Forman puentes de hidrógeno más
débiles que los alcoholes.
Acidez y basicidad de las aminas
Las aminas se comportan como bases a través del par
libre del nitrógeno. También se comportan como
ácidos débiles pudiendo desprotonarlas mediante el
empleo de bases muy fuertes (organolíticos)
Obtención de aminas
Las aminas se obtienen por reducción de nitrilos y amidas con el hidruro de litio y aluminio. La
transposición de Hofmann convierte las amidas en aminas con un carbono menos. La reducción de
azidas permite obtener aminas con el mismo número de carbonos que el haloalcano de partida.
La síntesis de Gabriel permite obtener aminas a partir del ácido ftálico.
Eliminación de Hofmann y Cope
Las aminas se pueden convertir en alquenos mediante las eliminaciones de Hofmann y Cope.
Reacción de Mannich
La reacción de Mannich conduce a 3-aminocarbonilos a partir de aldehídos o cetonas enolizables,
metanal y aminas primarias o secundarias.
Reacción de aminas con ácido nitroso
Las reacciones de aminas con ácido nitroso conduce al catión diazonio, muy reactivo. Esta
reacción tiene gran interés con aminas aromáticas, ya que permite introducir grupos muy
variados sobre el benceno (reacciones de Sandmeyer)
Acidez y Basicidad de Aminas Enviado por german el Mié, 16/09/2009 - 00:40.
Acidez de las aminas

Los hidrógenos del grupo amino son debidamente ácidos, pudiendo ser arrancados con bases muy
fuertes (organometálicos de litio). Por otro lado el par libre del nitrógeno es accesible a la
protonación convirtiendo a las aminas en bases aceptables.
Preparación de LDA
Para la desprotonación de aminas se utilizan bases muy fuertes como los organometálicos de litio.
Así, la preparación del diisopropilamiduro de litio (LDA) se realiza a partir de diisopropilamina y
buti-litio. El pKa del amoniaco y aminas alifáticas primarias se sitúa en 35, subiendo ligeramente
al aumentar el número y tamaño de los sustituyentes.
Comportamiento básico de las aminas
Las aminas actúan como bases a través del par libre del nitrógeno. La protonación del nitrógeno
genera las sales de amonio.
Formación de sales de amonio
Las aminas se protonan en medios ácidos formando sales de amonio.
AMIDAS Enviado por german el Mar, 15/09/2009 - 23:33.
Nomenclatura de amidas

Se nombran sustituyendo la terminación -o del alcano por -amida (etanamida).
Hidrólisis
Las amidas se hidrolizan a ácidos carboxílicos en medios ácidos o básicos y con condiciones
enérgicas.
Reducción a aminas y aldehídos
El hidruro de aluminio y litio las transforma en aminas y el DIBAL en aldehídos.
Formación de enolatos de amida y amidatos
En medios básicos forman amidatos por desprotonación del grupo -NH2 con hidrógenos de pKa 15.
La desprotonación del carbono α produce enolatos de amida.
Degradacion de Hofmann de amidas
En presencia de una base las amidas primarias reaccionan con Br2 sustituyéndose el grupo
carbonilo por un -NH2, reacción denominada transposición de Hofmann.
Hidrólisis de Amidas Enviado por german el Mar, 15/09/2009 - 23:55.
Las amidas se convierten por hidrólisis en ácidos carboxílicos. La reacción se puede realizar tanto
en medios ácidos como básicos fuertemente concentrados y requiere calentar durante varias
horas. Estas condiciones tan drásticas son necesarias dada escasa reactividad de las amidas frente
a los ataques nucleófilos, debida principalmente a la cesión el par solitario del nitrógeno.
Hidrólisis ácida de amidas
Mecanismo de la hidrólisis ácida

Hidrólisis básica de amidas
Preparación de aminas por reducción de azidas
La reacción de haloalcanos primarios y secundarios con azida de sodio produce alquilazidas, que por reducción con LiAlH4 dan lugar
a amidas.
Paso 1. Formación de la alquilazida
Paso 2. Reducción de la azida a amida con LiAlH4
Obsérvese que la amina formada tiene igual número de carbonos que el haloalcano de partida.
Síntesis de aminas por reducción de amidas
Las amidas se reducen con LiAlH4 para formar aminas. El número de carbonos de la amina final es igual al de la amida de partida.

Las lactamas (amidas cíclicas) reducen sin producirse la apertura del anillo.
Síntesis de aminas por transposición de Hofmann
Las amidas se convierten en aminas, con un carbono menos, mediante tratamiento con bromo en medio básico. Esta reacción es
conocida como transposición de Hofmann.
La amida reacciona con el bromo en medio básico formando una N-bromoamida, que reagrupa a isocianato. La hidrólisis del
isocianato produce el ácido carbámico, que descarboxila para dar la amina.
Síntesis de Gabriel
La síntesis de Gabriel permite obtener aminas primarias a partir de haloalcanos, sin que se formen mezclas de aminas secundarias y
terciarias.
Gabriel parte del ácido benceno-1,2-dicarboxílico [1], que por reacción con amoniaco produce Ftalimida[2]. El tratamiento básico de
la Ftalimida genera su sal [3], que se alquila por reacción con el haloalcano. Una hidrólisis final de la imida deja libre la amina
primaria y la sal del ácido benceno-1,2-dicarboxílico.

Aminación reductora
La aminación reductora consiste en formar una imina, a partir de aldehídos o cetonas y aminas, que se reduce en una etapa posterior a
amina. Esta reducción puede realizarse con H2 catalizado por Niquel o bien con NaBH3CN.
La reacción transcurre con formación de de la imina del propanal y amoniaco.
El doble enlace de la imina se reduce con H2, Ni, para formar la amina final.
Veamos un segundo ejemplo

En la primera etapa se forma la imina de ciclohexanona y metilamina
En la segunda etapa, el cianoborohidruro de sodio reduce la imina a amina.
Síntesis de aminas mediante apertura de epóxidos
Los epóxidos (oxaciclopropanos) abren por ataque de nucleófilos, debido a la importante tensión del anillo. Si el nucleófilo empleado
es amoniaco se obtiene un -aminoalcohol. También puede obtenerse este tipo de producto abriendo el epóxido con azida de sodio y
reduciendo en una etapa posterior.
La apertura del epóxido tiene lugar sobre el carbono menos sustituido, al tratarse de un medio básico.
También se puede abrir el epóxido con azida de sodio, reduciendo la azida formada con el hidruro de litio y aluminio.
Eliminación de Hofmann
La eliminación de Hofmann permite convertir aminas en alquenos. Es una reacción regioselectiva que sigue la regla de Hofmann,
formando el alqueno menos sustituido mayoritariamente.

Etapa 1. Metilación exahustiva de la amina. En esta etapa se hace reaccionar la amina con exceso de yoduro de metilo, para
formar una sal de amonio (buen grupo saliente).
Etapa 2. Tratamiento con óxido de plata acuoso. Sal básica que forma un hidróxido de amonio, precipitando el yoduro en forma
de yoduro de plata.
Etapa 3. Eliminación bimolecular. El hidróxido de amonio sufre una E2 al calentar, que da lugar al alqueno.
Al tratarse de una E2, la eliminación de Hofmann tiene estereoquímica ANTI.
Sintesis de aminas mediante alquilación directa
Las aminas se pueden preparar mediente reacciones de sustitución nucleófila entre haloalcanos y amoniaco.
El primer equivalente de amoniaco actúa como nucleófilo, sustituyendo al bromo. El segundo equivalente actúa como base
desprotonando la amina.
La amina formada, al igual que el amoniaco, es nucleófila y tiende a reaccionar con el haloalcano que queda libre en el medio,
formándose aminas secundarias y terciarias. Este problema hace que el método sea poco útil, debido a la mezcla final obtenida.
La amina formada vuelve a reaccionar con el haloalcano, alquilándose una segunda vez. Este problema recibe el nombre de
polialquilaciones.

Síntesis de aminas por reducción de nitrilos
Los nitrilos se pueden preparar por reacción de haloalcanos con cianuro de sodio. La reducción de nitrilos con LiAlH4 produce
aminas.
Paso 1. Obtención del nitrilo a partir de haloalcanos primarios o secundarios.
Paso 2. Reducción del nitrilo a amina
Obsérvese que la amina final tiene un carbono más que el haloalcano de partida.
Reducción de Amidas Enviado por german el Mié, 16/09/2009 - 00:01.
Reducción de amidas a aminas
Las amidas se reducen a aminas con el hidruro de aluminio y litio
Reducción de amidas a aldehídos
Las amidas se reducen a aldehídos con DIBAL (hidruro de diisobutilaluminio).
‹ Hidrólisis de Amidas
Enolatos y Amidatos Enviado por german el Mié, 16/09/2009 - 00:03.
Formación de amidatos

Los hidrógenos del grupo -NH2 y del carbono contiguo al carbonilo son ácidos. El hidrógeno del
grupo -NH tiene un pKa de 15 y su abstracción genera el ion amidato. Los iones amidato son
buenos nucleófilos y pueden reaccionar con haloalcanos, alquilándose.
Formación de enolatos de amida
El hidrógeno de la posición α posee un pKa de 30 y su abstracción genera el ion enolato de amida.
El ion enolato es muy nucleófilo y ataca a una gran variedad de electrófilos -haloalcanos,
aldehídos y cetonas, epóxidos..-.
Transposición de Hofmann Enviado por german el Mié, 16/09/2009 - 00:05.
Amidas para dar aminas con un carbono menos
Las amidas primarias en presencia de un halógeno y medio básico sufren una reacción llamada
transposición de Hofmann, que las convierte en aminas con un carbono menos que la amida de
partida. Este carbono se pierde en forma de dióxido de carbono.