Biología - 1bat - Tema 1
-
Upload
juangarcia -
Category
Documents
-
view
13 -
download
2
description
Transcript of Biología - 1bat - Tema 1

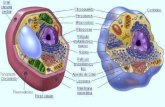
BIOLOGÍAApartado 1. Composición de los seres vivos
Características de los seres vivos
-Hacen las tres funciones vitales, nutrición, relación (se relacionan con el medio ambiente y reproducción) y se reproducen.
-Están formados por bioelementos que se combinan en biomoléculas
-Están formados por células.
Los seres vivos están formado por 70 bioelementos, de los cuales 30 se encuentran en todos los seres vivos.
Según la abundancia de los mismos se pueden clasificar en:
Primarios: N, O, C, H, S y P
Secundarios: Mg, Ca, Cl, Na y K
Oligoelementos: Fe, Mn, Cu, Zn….
Características de los bioelementos
BIOELEMENTOSINORGÁNICOS ORGÁNICOS
AGUA Y SALES MINERALES HIDRATOS DE CARBONOLÍPIDOS
PROTEINASÁCISO NUCLEICOS
-En la última capa tienen electrones que pueden compartir formando enlaces covalentes. Enlace covalente: Unión entre 2 no metales que comparten electros para completar el octeto
-El C, O y N pueden compartir más de un electrón para formar enlaces más rígidos.
-Son elementos ligeros capaces de formar enlaces covalentes estables pero fáciles de romper por los seres vivos para que los mismos puedan utilizar su energía.
-El carbono puede formar largas cadenas de C-C y puede unirse a otros elementos químicos; aumentado la posibilidad de formar grupos funcionales.
-Los compuestos orgánicos están muy reducidos más % de H que de O; Estos compuestos tienden a oxidarse formando compuestos de baja energía como CO2 y H2O. La energía liberada es aprovechada por los organismos y sus funciones vitales.
-Los bioelementos forman compuestos que generalmente son solubles en agua o son polares.
-El S i P tienen un mayor peso atómico y los enlaces que forman son menos estables y son idóneos para formar enlaces con de mayor energía.

2. Agua
-El agua es la molécula más importante en los server vivos no obstante su porcentaje no es igual en todos los seres vivos. En unos organismos el porcentaje de agua varia de unos tejidos a otros, los que presentan una gran actividad biológica (cerebro) tiene más que los que presentan una baja actividad (huesos). El porcentaje depende también de la edad del organismo.
Las moléculas de agua están formadas por 2 átomos de H y uno de O, formando un enlace covalente en forma de V. A pesar de ser eléctricamente neutra, la molécula de agua es dipolar ya que aparece una región electropositiva y otra electronegativa. Presenta un dipolo el cual tiene un polo negativo apuntando al átomo de O y el polo positivo se encuentra sobre la bisectriz del ángulo formado por los enlaces O-H
Negativo
Positivo Positivo
Las estructuras dipolares que forman las moléculas de agua pueden atraerse entre sí formando lo que se denomina como enlace o puente de hidrogeno, que es una interacción muy importante que le da todas las características especiales que posee el agua.
Los puentes de H enlazan grupos de tres o de cuatro moléculas de agua formando una extensa red mantenida por estos enlaces que explican los hechos de que el agua siga liquida a temperatura ambiente.
2.1 Propiedades del agua
La presencia de estos enlaces de hidrogeno y la estructura dipolar de la molécula son las responsables de las propiedades siguientes
-Elevada calor de vaporización (La cantidad de energía que hay que infligir en el agua para que cambie su estado de líquido a gaseoso
-La propiedad de que el estado sólido del agua (hielo) sea menos denso que su estado líquido, esto es debido a los puentes de hidrogeno.
-Elevada color específica a decir se necesita mucha energía para elevar la temperatura del agua. Los puentes de Hidrógeno liberan energía cunado se forman y absorben energía cunado se destruyen, reduciendo al mínimo los cambios térmicos en los seres vivos.
-Momento dipolar elevado: el carácter dipolar explica la propiedad de ser un buen disolvente para todo tipo de substancias de componentes polares
-Elevada fuerza de cohesión-adhesión: los puentes de hidrógeno mantienen juntas las moléculas, la atracción de agua. Eso permite que el agua forme columnas continuas o que la superficie oponga una gran resistencia a romperse (elevada tensión superficial), esto significa que las moléculas son empujadas hacia arriba por atracción adhesiva, la atracción cohesiva con otras moléculas. Como resultado ambas fuerzas el agua ira desplazándose hacia arriba hasta que la atracción sea contrastada por la fuerza de la gravedad.
-En estado sólido es menos densa que en estado líquido es do también es debido a los puentes de hidrogeno; cuando el agua se congela, los enlaces de hidrógeno se hacen permanentes y el agua adquiere una estructura cristalina fija que ocupa más volumen que la maya cristalina en estado líquido, por eso la densidad del agua es menor en el estado sólido que en el estado líquido. Esta propiedad permite la existencia de vida majo los mares y los lagos.
O
H H
Los puentes de hidrogeno se producen cuando El O- se atrae con un H+ durante un periodo extremadamente corto

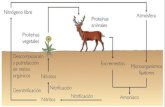
3. SALES MINERALES
Reforzar las estructuras sólidas de los cuerpos vivos
Formas precipitadas (solidos)
Sales minerales -Intervienen en algunas reacciones químicas . Formas disueltas (líquidos) -Interviene en el proceso de la osmosis
-Interviene en la contracción muscular y en la -transmisión de impulsos nerviosos
4. BIOMOLÉCULAS ORÁNICAS
Glúcidos (Hidratos de carbono o azucares)
Los glúcidos son biomoléculas orgánicas formadas básicamente por Carbono, Oxigeno y Nitrógeno. Aunque que generalmente, aunque no siempre, tengan la formula empírica Cn(H20)n, de ahí que estas substancias hayan estado conocidas con el nombre hidratos carbono, DENOMINACIÓN ERRONEA, ya que químicamente no son compuestos de agua y carbono sino que son polialcoholes con un grupo aldehído o atona. A pesar de eso muchas veces los glúcidos son denominados de esa manera en el lenguaje cuotidiano.
Se pueden clasificar según el número molecular en:
-Monosacáridos: son los más simples, están formados por una molécula cualquiera de 3 a 8 átomos de carbono. Químicamente están construidas por una sola cadena a de polialcoholes con un grupo aldehídos o cetona. Los que tiene un grupo aldehico localizado siempre en el C1, se denominan aldeosos y los que tienen un grupo atómico localizado siempre en el C2 se denominan cenatonas.
5. Características químicas
Son dulces, solubles en agua y forman cristales blancos que por la calor pueden caramelizar. Gracias a su cuerpo aldéhido o cetona, pueden reducir al Cu^+2 propiedad que se utiliza por reconocimiento químico ( Reactivo de Flesh). Su función principal es suministrar energía al ser vivios, aunque en algunos de ellos forman parte de moléculas más complejas como ácidos nucleicos.
-Disacáridos: formados por la unión de 2 monosacáridos mediante un enlace O-glúcido con la perdida de una molécula de agua. Tiene las mismas propiedades físicas que los monosacáridos. Son reductores a excepto de la sacarosa.
Los que se encuentran libres en la naturaleza tienen funciones energéticas. Los monosacáridos no existen, sino que aparecen se descomponen los polisacáridos.
-Oligoelementos> Están formados por la unión de varios monosacáridos. Generalmente entre 3 y 15, unidos por los enlaces O-glúcidos. Hay una gran diversidad de oligosacáridos, ya que varía su número y el tipo de monosacárido que se unen. Su propiedad es la capacidad de almacenamiento de información, y de hecho, esta es la principal función de estos compuestos en el lugar donde se encuentran es la superficie externa de la membrana celular externa, enlazados con moléculas de proteínas y lípidos. La función es dar a la célula su señal de identidad.

-Polisacáridos Están formados por la unión de muchos monosacáridos mediante enlaces O-glúcidos.
No son dulces, ni cristalinos, so son solubles en agua, aunque algunos como el almidón forman soluciones coloidales (cuando se “disuelven” queda como barro) No poseen carácter reductor (no reaccionan con Fehling) Hacen funciones de reserva energética o bien funciones estructurales.
6. Lípidos
Los lípidos son biomoleculas organicas formadas por Carbono, Oxigeno y Hidrogeno, aunque los más complejos también llevan Nitrógeno, Fosforo y Azufre. Desde el punto de vista químico son muy heterogéneos, pero también tiene las propiedades físicas siguientes.
-Son insolubles en agua
-Son solubles en disolventes orgánicos no polares
-Tienen poca densidad
Los lípidos se clasifican según su composición química en:
-Ácidos Grasos
Triglicéridos
Simples Ceres
-Lípidos fosfoglicéridos
Compuestos
Esfingoíipidos
Esteroides
-Lípidos con ácidos grasos Isoprenoides
7. Ácidos grasos
Son los compuestos básicos de la mayoría de los lípidos. Estan formados por una hidrocarburada y un grupo de acidos en el extremo, son por tanto bipolares (Infipaticos), tienen una parte polar y una parte apolar. Pueden ser saturados (Enlaces simples) o estructurados ( enlaces dobles o triples)
8. Triglicéridos o grasas
Están formados por una molécula de glicerina unida a 5 ácidos grasos, que pueden ser iguales o diferentes. Son moléculas apolares y sus funciono principal es de reserva energética y también sirve de aislante térmico.
-Ceres: Están formados por un ácido graso de cadena larga y un alcohol de cadena larga. Son apolares e impermeables, y su función s de protección.
-Fosfolípidos: Tiene en su molécula un ácidos fosfórico( son anfipaticos ( parte polar y parte no polar) y debido a eso su característica de que su función sea formar las membranas de las células, forman una doble capa en la cual la parte no polar se queda en contacto con el centro y la parte polar con el exterior en contacto con el agua.

9. Esteroides
Son derivados de hidrocarbonos tetrácido.
Un importante grupo de esteroides son los esteroles, destacan el colesterol, que se encuentra en la membrana plasmática de las células animales y unido a proteínas en el plasma sanguíneo. El colesterol es el precursor de la vitamina D y de algunas hormonas.
10. Isoprenoides
Son moléculas de doble enlace, cosa que hace que algunos sean pigmentos responsables de la coloración de muchos tejidos. El betacoroide es el precursor de la vitamina A.