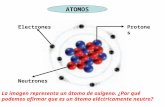
cronograma de los atomos
-
Upload
katiagelvis -
Category
Documents
-
view
13.325 -
download
0
Transcript of cronograma de los atomos

Republica bolivariana de VenezuelaInstituto radiofónico fe y alegríaEducación Básica de Jóvenes y Adultos por RadioMérida edo Mérida
Hecho porFabiola Vilera A
C.I.: 21183235Semestre: 11
Sección: B
Introducción

El Átomo, es la unidad más pequeña posible de un elemento químico. En la
filosofía de la antigua Grecia, la palabra "átomo" se empleaba para referirse a la parte de
la materia más pequeña que podía concebirse. Esa "partícula fundamental", se
consideraba indestructible. El estudio sobre el átomo ha avanzado muy lentamente a lo
largo de los siglos ya que la gente se limitaba a especular sobre él.
Con la llegada de la ciencia experimental en los siglos XVI y XVII, los avances
en la teoría atómica se hicieron más rápidos. Los químicos se dieron cuenta muy pronto
de que todos los líquidos, gases y sólidos pueden descomponerse en sus constituyentes
últimos, o elementos que ligados forman una unión íntima conocida como compuesto
químico.
Como se vera dentro de la estructura del trabajo nos encontramos que han
habido cambios importantes a través de los siglos aunque se han mantenido ciertas
características iguales en las diferentes investigaciones realizadas por lo que las
semejanzas encontradas en todos los científicos son similares no encontrando casi
diferencia entre ellos o diferencias muy pequeñas

Año Científico Aporte Tesis Central Del Aporte
Modelo
1808
Jhon dalton Define los átomos como la unidad constitutiva de los elementos (retomando las ideas básicas de los atomistas griegos).
Estructura de la materia
1897
Joseph jhon thomson
Sugirió el modelo atómico que tomaba en cuenta el electrón, se suponía que los electrones estaban en reposo dentro del átomo y qué el conjunto era eléctricamente neutro
Descubrió el electrón dentro del átomo, que contenía una nube positiva con partículas negativas llamados electrones
1990Ernest
RutherfordDetermino la magnitud de las cargas positivas del núcleo atómico y resultado del experimento indican que el diámetro de la (porción desocupada) del átomo
estudió los componentes de la radiación que ocurre espontáneamente en la Naturaleza
1922Neils Bohr El número de electrones de
cada elemento en su estado natural es característico, puesto que depende de su número atómico. Estos electrones estarán distribuidos en diferentes niveles energéticos que pueden funcionar como estaciones de paso para aquellos que reciben suficiente energía para saltar de un nivel a otro
postula que los electrones giran a grandes velocidades alrededor del núcleo atómico. Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía
1924Louis de Broglie
los electrones en su movimiento deben tener una cierta longitud de onda por consiguiente debe haber una relación entre las propiedades de los electrones en movimiento y las propiedades de los fotones.
sugirió que el comportamiento dual de la onda-partícula dado a la luz, podría extenderse con un razonamiento similar, a la materia en general

Año Científico Aporte Tesis Central Del Aporte
Modelo
1925Wolfgang Ernst Pauli
partículas que forman estados cuánticos antisimétricos y que tienen espín semiéntelo. Son fermiones, por ejemplo, los protones, los neutrones, y los electrones, los tres tipos de partículas subatómicas que constituyen la materia ordinaria
Separación quántica de los fermiones.
1927Schrödinger . es un modelo quántico no
relativista se basa en la solución de la ecuación Schrödinge r para un potencial electrostático con simetría esférica, llamado también átomo hidrogeno idee.
modifica el modelo atómico de Bohr, en el cual los electrones sólo giraban en orbitas circulares, al decir que también podían girar en orbitas elípticas
1932James chadwick
la dificultad de su descubrimiento debía a que ésta partícula carecía de carga eléctrica
Su descubrimiento resolvió el problemas de la radiación alfa y una mejora del modelo atómico de Rutherford

Diferencias Y Semejanzas Entre Los Modelos Atómicos
Semejanzas
Jhon dalton, Joseph jhon thomson, Ernest Rutherford, Neils Bohr, Louis de Broglie,
Wolfgang Ernst Pauli, Schrödinger, James chadwick, todos estos científicos estudiaron
la estructura de la materia dentro de este tema estudiaron el átomo y las partículas o
iones positivos o negativos que estuvieran en su estructura. Estas fueron las semejanzas
existentes y mediante sus aportes fue evolucionando el conocimiento de la estructura de
la materia y el átomo.
Diferencias
Estos científicos fueron evolucionando la estructura del átomo, porque fueron
diferenciando la estructura del modelo que habían echo otros científicos, además
seguian como base los modelos que habían propuesto ellos, pero los fueron
diferenciando y fue evolucionando el modelo del átomo hasta el modelo actual.
Porque la ciencia se ha valido de diferentes modelos para explicar la estructura de
la materia
Porque esos modelos fueron evolucionando a medida que se fue investigando sus
características esenciales hasta llegar al modelo actual, esto no significa que no se ha
seguido estudiando sobre ello, debido a los cambios que han encontrado al pasar de los
tiempo.
Conclusión

La evolución de los modelos físicos del átomo se vio impulsada por los datos
experimentales. El modelo de Rutherford, en el que los electrones se mueven alrededor
de un núcleo positivo muy denso, explicaba los resultados de experimentos de
dispersión, pero no el motivo de que los átomos sólo emitan luz de determinadas
longitudes de onda (emisión discreta).
Bohr partió del modelo de Rutherford pero postuló además que los electrones
sólo pueden moverse en determinadas órbitas; su modelo explicaba ciertas
características de la emisión discreta del átomo de hidrógeno, pero fallaba en otros
elementos.
El modelo de Schrödinger, que no fija trayectorias determinadas para los
electrones sino sólo la probabilidad de que se hallen en una zona, explica parcialmente
los espectros de emisión de todos los elementos; sin embargo, a lo largo del siglo XX
han sido necesarias nuevas mejoras del modelo para explicar otros fenómenos
espectrales.