Ecuacion
-
Upload
nicolas-tovar -
Category
Documents
-
view
7 -
download
0
description
Transcript of Ecuacion
-
Ecuacin de Arrhenius 1
Ecuacin de ArrheniusLa ecuacin de Arrhenius es una expresin matemtica que se utiliza para comprobar la dependencia de laconstante de velocidad (o cintica) de una reaccin qumica con respecto a la temperatura a la que se lleva a cabo esareaccin.[1] La ecuacin fue propuesta primeramente por el qumico holands J. H. van 't Hoff en 1884; cinco aosdespus en 1889 el qumico sueco Svante Arrhenius dio una justificacin fsica y una interpretacin para la ecuacin.Actualmente, es vista mejor como una relacin emprica.[2] Puede ser usada para modelar la variacin de temperaturade coeficientes de difusin, poblacin de vacancias cristalinas, velocidad de fluencia, y muchas otras reacciones oprocesos inducidos trmicamente.
Informacin generalDicho de manera breve, la ecuacin de Arrhenius da la dependencia de la constante de velocidad k de reaccionesqumicas a la temperatura T (en temperatura absoluta, tales como kelvins o grados Rankine) y la energa deactivacin[3] Ea", de acuerdo con la expresin:
[1]
donde:
: constante cintica (dependiente de la temperatura): factor preexponencial o factor de frecuencia. Refleja la frecuencia de las colisiones.
: energa de activacin, expresada en J/mol.: constante universal de los gases. Su valor es 8,3143 JK-1mol-1
: temperatura absoluta [K]
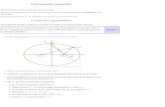
Grfico de Arrhenius
Ejemplo:Decaimiento de dixido de nitrgeno
2 NO2 2 NO + O2
Grfico convencional:k respecto a T
-
Ecuacin de Arrhenius 2
Grfico de Arrhenius:ln(k) respecto a 1/T
Para utilizar la ecuacin de Arrhenius como modelo de regresin lineal entre las variables y , la ecuacinpuede ser reescrita como:
Un grfico de Arrhenius muestra el logaritmo de las constantes cinticas ( en el eje de las ordenadas encoordenadas cartesianas) graficado con respecto al inverso de la temperatura ( , en el eje de las abcisas). Losgrficos de Arrhenius son ocasionalmente utilizados para analizar el efecto de la temperatura en las tasas de rapidezde las reacciones qumicas. Para un nico proceso trmicamente activado de velocidad limitada, un grfico deArrhenius da una lnea recta, desde la cual pueden ser determinados tanto la energa de activacin como el factorpreexponencial.Cuando se grafica de la forma descrita anteriormente, el valor de la interseccin en el eje y corresponder a ,y la pendiente de la lnea ser igual a .El factor preexponencial, A, es una constante de proporcionalidad que toma en cuenta un nmero de factores talescomo la frecuencia de colisin y la orientacin entre las partculas reaccionantes.
La expresin representa la fraccin de las molculas presentes en un gas que tienen energa igual osuperior a la energa de activacin a una temperatura dada.
Interpretacin cintica de la ecuacin de ArrheniusArrhenius argument que para que los reactivos se transformen en productos, deben primero adquirir una mnimacantidad de energa, llamada la "energa de activacin" Ea. A una cierta temperatura absoluta T, la fraccin de lasmolculas que tiene una energa cintica mayor que Ea puede ser calculada a partir de la distribucin deMaxwell-Boltzmann de la mecnica estadstica, y resulta ser proporcional a . El concepto de energa deactivacin explica la naturaleza exponencial de la relacin, y de una forma u otra est presente en todas las teorascinticas.
-
Ecuacin de Arrhenius 3
Teora de las colisionesUn ejemplo viene de la "teora de las colisiones" de las reacciones qumicas, desarrollada por Max Trautz y WilliamLewis en los aos 1916-1918. En esta teora, se supone que las molculas reaccionan si colisionan con una energacintica relativa a lo largo de sus lneas de centro, que exceda Ea. Esto lleva a una expresin muy similar a laecuacin de Arrhenius.
Teora del estado de transicinOtra expresin parecida a la ecuacin de Arrhenius aparece en la "teora del estado de transicin" de las reaccionesqumicas, formulada por Eugene Wigner, Henry Eyring, Michael Polanyi y M. G. Evans en los aos 1930s. Estotoma varias formas, pero una de las ms comunes es
donde G es la energa libre de Gibbs de activacin, kB es la constante de Boltzmann, y h es la constante de Planck.A primera vista esto luce como un exponencial multiplicado por un factor que es lineal en temperatura. Sin embargo,se debe recordar que la energa libre es por s misma una cantidad dependiente de la temperatura. La energa libre deactivacin es la diferencia de un trmino de entalpa y un trmino de entropa multiplicada por la temperaturaabsoluta. Cuando todos los detalles son considerados, se termina con una expresin que nuevamente toma la formade la ecuacin exponencial de Arrhenius multiplicada por una funcin de T que vara lentamente. La forma precisade la dependencia de temperatura depende de la reaccin, y puede ser calculada usando frmulas de la mecnicaestadstica, que envuelven las funciones de particin de los reactivos y del complejo activado.
Limitaciones de la idea de la energa de activacin de ArrheniusTanto la energa de activacin de Arrhenius como la constante de velocidad k son determinadas experimentalmente,y representan parmetros macroscpicos especficos de la reaccin que no estn relacionados de manera simple a lasenergas umbrales y al xito de las colisiones individuales a nivel molecular. Considrese una colisin particular (unareaccin elemental) entre las molculas A y B. El ngulo de colisin, la energa traslacional relativa, la energa(particularmente la vibracional) interna, todos esos factores determinarn la oportunidad de que la colisin produzcauna molcula AB. Las medidas macroscpicas de E y k son el resultado de muchas colisiones individuales condiferentes parmetros de colisin. Para probar las velocidades de reaccin a nivel molecular, los experimentos tienenque ser realizados bajo condiciones casi colisionales y este tpico es llamado en ocasiones dinmica de reaccionesmoleculares.
Referencias[1] Ecuacin de Arrhenius (http:/ / www. iupac. org/ goldbook/ A00446. pdf) - IUPAC Goldbook definition[2] Kenneth Connors, Chemical Kinetics, 1990, VCH Publishers[3] Energa de activacin de Arrhenius (http:/ / www. iupac. org/ goldbook/ A00102. pdf) - IUPAC Goldbook definition
-
Fuentes y contribuyentes del artculo 4
Fuentes y contribuyentes del artculoEcuacin de Arrhenius Fuente: http://es.wikipedia.org/w/index.php?oldid=50885216 Contribuyentes: Airunp, Daniel Carracelas, Der Kreole, Diegusjaimes, Folkvanger, Ippazio, JorgeGG,Nejbet, Numbo3, Omegakent, Paul 14, Roimergarcia, Rsg, Satans va de retro, Sxim, Tamorlan, UAwiki, VanKleinen, 17 ediciones annimas
Fuentes de imagen, Licencias y contribuyentesArchivo:NO2 Arrhenius k against T.svg Fuente: http://es.wikipedia.org/w/index.php?title=Archivo:NO2_Arrhenius_k_against_T.svg Licencia: GNU Free Documentation LicenseContribuyentes: Zivilverteidigung (JPG version), Matthias M. (SVG version)Archivo:NO2 Arrhenius lnk against T^-1.svg Fuente: http://es.wikipedia.org/w/index.php?title=Archivo:NO2_Arrhenius_lnk_against_T^-1.svg Licencia: GNU Free Documentation LicenseContribuyentes: Zivilverteidigung (JPG version), Matthias M. (SVG version)
LicenciaCreative Commons Attribution-Share Alike 3.0 Unported//creativecommons.org/licenses/by-sa/3.0/
Ecuacin de ArrheniusInformacin general Grfico de Arrhenius Interpretacin cintica de la ecuacin de Arrhenius Teora de las colisiones Teora del estado de transicin Limitaciones de la idea de la energa de activacin de Arrhenius
Referencias
Licencia