El Descubrimiento de Las Enzimas
-
Upload
joegalindo -
Category
Documents
-
view
1.904 -
download
0
Transcript of El Descubrimiento de Las Enzimas

BIOTECNOLOGÍA
Alumnos: Galindo Vásquez joe De La Cruz Bernilla Gonsalo Perez Salazar Nixon Zapata Serquen Martin
Docente: Roble Ruiz Juan Francisco
Año/ Ciclo: 2010-IV
Aula: A
Turno: Mañana.
INTRODUCCION
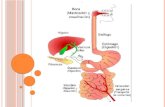
La Glucosa es un azúcar que es utilizado por los tejidos como forma de energía al
combinarlo con el oxígeno de la respiración. Cuando comemos el azúcar en la sangre se
Facultad de ingeniería, arquitectura y urbanismo
Escuela de ingeniería industrial
Pimentel, 2010

eleva, lo que se consume desaparece de la sangre, para ello hay una hormona reguladora
que es la insulina producida por el páncreas (islotes pancreáticos). Esta hormona hace
que la glucosa de la sangre entre en los tejidos y sea utilizada en forma de glucógeno,
aminoácidos, y ácidos grasos. Cuando la glucosa en sangre está muy baja, en
condiciones normales por el ayuno, se secreta otra hormona llamada glucagón que hace
lo contrario y mantiene los niveles de glucosa en sangre.
El tejido más sensible a los cambios de la glucemia es el cerebro, en concentraciones
muy bajas o muy altas aparecen síntomas de confusión mental e inconsciencia.
La glucosa es la principal fuente de energía para el metabolismo celular. Se obtiene
fundamentalmente a través de la alimentación, y se almacena principalmente en el
hígado, el cual tiene un papel primordial en el mantenimiento de los niveles de glucosa en
sangre (glucemia).
Para que esos niveles se mantengan y el almacenamiento en el hígado sea adecuado, se
precisa la ayuda de la insulina, sustancia producida por el páncreas. Cuando la insulina es
insuficiente, la glucosa se acumula en sangre, y si esta situación se mantiene, da lugar a
una serie de complicaciones en distintos órganos. Esta es la razón principal por la que se
produce aumento de glucosa en sangre, pero hay otras enfermedades y alteraciones que
también la provocan. Por tanto, la determinación de glucosa en sangre (glucemia) es útil
para el diagnóstico de numerosas enfermedades metabólicas, fundamentalmente de la
diabetes mellitus. También es necesaria esta prueba, una vez diagnosticada la diabetes,
para controlar la dosis de insulina que se debe administrar para tratarla.
La determinación de glucosa en orina (glucosuria), suele formar parte del análisis de orina
rutinario. En condiciones normales, no debería haber glucosa en la orina, pero cuando la
cantidad en sangre supera un determinado límite, empieza a ser eliminada a través del
riñón con la orina. Cuanta más cantidad de glucosa haya en la sangre, más se eliminará
por la orina. La determinación en orina es menos exacta y menos útil que la determinación
en sangre.
El descubrimiento de las enzimas
Hoy se sabe que la obtención del pan y la cerveza fueron resultado del proceso de fermentación alcohólica, uno de los procesos enzimáticos más antiguos.

Y que la producción del queso a partir de la leche, también se debe a un proceso enzimático. Antes del siglo XIX, se creía que estos fenómenos y otros similares eran reacciones espontáneas. No se conocía de la existencia y función de las enzimas. Hasta que en 1857 el químico francés Louis Pasteur comprobó que la fermentación sólo ocurre en presencia de células vivas. Más tarde, en 1897,el químico alemán Eduard Buchner descubrió que un extracto de levadura, libre de células, puede producir fermentación alcohólica. Este descubrimiento demostró que las levaduras producen enzimas y éstas llevan a cabo la fermentación. A partir del descubrimiento de Buchner, los científicos asumieron que, las fermentaciones y las reacciones vitales eran producidas por enzimas. Sin embargo, todos los intentos de aislar e identificar su naturaleza química fracasaron.
En 1926, el bioquímico estadounidense James B. Sumner consiguió aislar y cristalizar la ureasa. Cuatro años después su colega John Howard Northrop aisló y cristalizó la pepsina y la tripsina y demostró también la naturaleza proteica de las enzimas.
En los últimos años, la investigación sobre la química enzimática ha permitido aclarar algunas de las funciones vitales más básicas. La ribonucleasa, una enzima descubierta en 1938 por el bacteriólogo estadounidense René Jules Dubos y aislada en 1946 por el químico estadounidense Moses Kunitz, fue sintetizada por científicos estadounidenses en 1969. Dicha síntesis permitió identificar aquellas áreas de la molécula que son responsables de sus funciones químicas, e hizo posible crear enzimas es pecializadas con propiedades de las que carecen las sustancias naturales. Este potencial se ha visto amplio durante los últimos años por las técnicas de ingeniería genética que han hecho posible la producción de algunas enzimas en grandes cantidades
¿Qué son las enzimas y qué función cumplen?
Las enzimas son una clase especial de proteínas que aceleran la velocidad de las reacciones químicas que ocurren en una célula. Por esto se las conoce como

“catalizadores biológicos”. Las enzimas ayudan en procesos esenciales tales como la digestión de los alimentos, el metabolismo, la coagulación de la sangre y la contracción muscular. El modo de acción es específico ya que cada tipo de enzima actúa sobre un tipo particular de reacción y sobre un sustrato específico.
Para realizar su función, una enzima reconoce una molécula específica, llamada sustrato. Cada enzima une a su sustrato específico en el sitio activo y provoca en él un cambio químico, por el cual se obtiene un producto. El cambio implica la formación o rotura de un enlace covalente. La enzima que participa en la reacción no sufre modificaciones, y puede volver a actuar sobre otro sustrato del mismo tipo. En ausencia de las enzimas, las reacciones bioquímicas serían extremadamente lentas y la vida no sería posible. Lasenzimas pueden aumentar la velocidad de las reacciones en un millón de veces.
Enzimas isomerasa
En bioquímica una enzima isomerasa es una enzima que transforma un isómero de un compuesto químico en otro, entonces decimos que lo puede transformar una molécula de glucosa en fructosa.
En estas reacciones, las enzimas actúan sobre unas moléculas denominadas sustratos, las cuales se convierten en moléculas diferentes denominadas productos. Casi todos los procesos en las células necesitan enzimas para que ocurran a unas tasas significativas. A las reacciones mediadas por enzimas se las denomina reacciones enzimáticas.
Las enzimas más utilizadas son la amilasa, la glucoamilasa, la glucosa isomerasa y varias proteasas. Solamente se emplean unas 20 enzimas en cantidades apreciables. De ellas, algunas tienen el suficiente interés industrial como para ser comercializadas en los mercados de materias primas.
Enzimas y biotecnología
La mayoría de los procesos biotecnológicos tradicionales como la obtención de yogur, la producción de cerveza o la fermentación de la uva para fabricar vino, son realizados por las enzimas que cada microorganismo produce para su particular metabolismo. Sin

embargo también es posible realizar los procesos biotecnológicos con las enzimas, en ausencia de los microorganismos.
La mayoría de las enzimas industriales se extraen de bacterias y hongos.
Entre ellas:
Proteasa de bacilo, Amiloglucosidasa, (α) Amilasa de bacilo, Glucosa isomerasa, Cuajo microbiano, (α) Amilasa fúngica, Pectinasa, Proteasa fúngica. Las enzimas presentan muchísimas aplicaciones y su utilización en el ámbito industrial se lleva a cabodesde hace muchos años. Sus características específicas permiten a los industriales ejercer un control más estricto de la calidad de sus productos.
En el siguiente esquema se mencionan algunas aplicaciones industriales de las enzimas:
Utilización

Se trata de una patata a la que se la ha incorporado genes procedentes de bacterias que producen enzimas (alfa amilasa) que descomponen la fécula de la patata en glucosa, y una segunda enzima (glucosa isomerasa) que transforma la glucosa en fructosa. Estas enzimas solo trabajan a altas temperaturas. El resultado es una patata que aparentemente es normal, pero que en cuanto se calienta a unos 65º se transforma en una pequeña fábrica química transformando la fécula en fructosa, un edulcorante que se utiliza enmuchos productos alimentarios, incluyendo aquellos que son especiales para diabéticos, que no toleran el azúcar normal (sacarosa).
La glucosa isomerasa se emplea para la transformación del jarabe deglucosa en fructosa, que es un sustituto de la sacarosa con crecientedemanda industrial. Como se verá, la elaboración de esta enzima incluyeuna tecnología de cierta complejidad, inmovilización
Clasificación de enzimas
El nombre de una enzima suele derivarse del sustrato o de la reacción química que cataliza, con la palabra terminada en -asa. Por ejemplo, lactasa proviene de su sustrato lactosa; alcohol deshidrogenasa proviene de la reacción que cataliza que consiste en "deshidrogenar" el alcohol.
La Unión Internacional de Bioquímica y Biología Molecular ha desarrollado una nomenclatura para identificar a las enzimas basada en los denominados Números EC.
De este modo, cada enzima queda registrada por una secuencia de cuatro números precedidos por las letras "EC". El primer número clasifica a la enzima en base a su mecanismo de acción. A continuación se indican las seis grandes clases de enzimas existentes en la actualidad:
EC1 Oxidorreductasas: catalizan reacciones de oxidorreducción o redox. Precisan la colaboración de las coenzimas de oxidorreducción (NAD+, NADP+, FAD) que aceptan o ceden los electrones correspondientes. Tras la acción catalítica, estas coenzimas quedan modificadas en su grado de oxidación, por lo que deben ser recicladas antes de volver a efectuar una nueva reacción catalítica. Ejemplos: deshidrogenasas, peroxidasas.
EC2 Transferasas: transfieren grupos activos (obtenidos de la ruptura de ciertas moléculas) a otras sustancias receptoras. Suelen actuar en procesos de interconversión de monosacáridos, aminoácidos, etc. Ejemplos: transaminasas, quinasas.
EC3 Hidrolasas: catalizan reacciones de hidrólisis con la consiguiente obtención de monómeros a partir de polímeros. Actúan en la digestión de los alimentos, previamente a otras fases de su degradación. La palabra hidrólisis se deriva de hidro → 'agua' y lisis → 'disolución'. Ejemplos: glucosidasas, lipasas, esterasas.

EC4 Liasas: catalizan reacciones en las que se eliminan grupos H2O, CO2 y NH3 para formar un doble enlace o añadirse a un doble enlace. Ejemplos: descarboxilasas, liasas.
EC5 Isomerasas: actúan sobre determinadas moléculas obteniendo de ellas sus isómeros funcionales o de posición, es decir, catalizan la racemización y cambios de posición de un grupo en determinada molécula obteniendo formas isoméricas. Suelen actuar en procesos de interconversión. Ejemplo: epimerasas (mutasa).
EC6 Ligasas: catalizan la degradación o síntesis de los enlaces denominados "fuertes" mediante al acoplamiento a moléculas de alto valor energético como el ATP. Ejemplos: sintetasas, carboxilasas.
Cuadro de clasificación de las enzimas


Glucosa isomerasa
La glucosa isomerasa es una enzima, presente en gran parte de los seres vivos cataliza la reacción reversible de glucosa a fructosa. En el citoplasma, forma parte de las rutas metabólicas de la glucólisis y la gluconeogénesis, y en la matriz extracelular funciona como factor neurotrófico para cierto tipo de neuronas.

Isomerasas
Transforman ciertas sustancias en otras isómeras, es decir, de idéntica formula empírica pero con distinto desarrollo.
Son las enzimas que catalizan diversos tipos de isomerización, sea óptica, geométrica, funcional, de posición, etc.
Se dividen en varias subclases Las racemasas y las epimerasas: Actúan en la racemización de los aminoácidos y en la epimerización de los azúcares. Las primeras son en realidad pares de enzimas específicas para los dos isómeros y que producen un solo producto común.
Las isomerasas cis ± trans: Modifican la configuración geométrica a nivel de un doble ligadura.
Las óxido ± reductasas intramoleculares catalizan la interconversión de aldosas y cetosas, oxidando un grupo CHO y reduciendo al mismo tiempo al C = O vecino, como en el caso de la triosa fosfato isomerasa, presente en el proceso de la glucólisis
en otros casos cambian de lugar dobles ligaduras, como en la (tabla) isopentenil fosfato isomerasa, indispensable en el cambio biosinético del escualeno y el colesterol
Estructura Química
Glucosa o dextrosa, es una forma de azúcar encontrada en las frutas y en la miel. Es un
monosacárido con la misma fórmula empírica que la fructosa pero con diferente
estructura. Es una hexosa, es decir, que contiene 6 átomos de carbono.
Todas las frutas naturales tienen cierta cantidad de glucosa (a menudo con fructosa), que
puede ser extraída y concentrada para hacer un azúcar alternativo. Pero a nivel industrial
tanto la glucosa líquida (jarabe de glucosa) como la dextrosa (glucosa en polvo) se
obtienen a partir de la hidrólisis enzimática de almidón de cereales (generalmente trigo o
maíz).
Molécula (C6H12O6) es una Aldohexosa (Aldehído pentahidroxilado) y un monosacárido.
La glucosa es el 2"compuesto orgánico más abundante de la naturaleza, después de la

celulosa. Es la fuente principal de energía de las células, mediante la degradación
catabólica, y es el componente principal de polímeros de importancia estructural como la
celulosa y de polímeros de almacenamiento energético como el almidón. En su forma (D-
Glucosa) sufre una ciclación hacia su forma hemiacetálica para lograr sus formas furano y
pirano (D-glucofuranosa y D-glucopiranosa) que a su vez presentan anómeros Alpha y
Beta. Estos anómeros no presentan diferencias de composición estructural, pero si
difieren de Características físicas y químicas. La D-(+)-glucosa es uno de los compuestos
más importantes para los seres vivos, incluyendo a seres humanos. En su forma ß -D-
glucopiranosa, una molécula de glucosa se une a otra gracias a los -OH de sus carbonos
1-4 para formar Celobiosa[1-4] a través de un enlace ß , y al unirse varias de estas
moléculas, formar Celulosa.
















![metabolismo - [DePa] Departamento de Programas …depa.fquim.unam.mx/amyd/archivero/metabolismo_4667.pdf · Descubrimiento de diversas enzimas y los mecanismos empleados ... oxidasa](https://static.fdocumento.com/doc/165x107/5a7400807f8b9a93088b72d0/metabolismo-depa-departamento-de-programas-depafquimunammxamydarchiverometabolismo4667pdf.jpg)

