ENLACE-COVALENTE
-
Upload
santiago-garrido -
Category
Documents
-
view
16 -
download
0
description
Transcript of ENLACE-COVALENTE
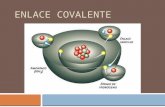
Enlace covalente : Lo primero recordar que los tomos estn formados por protones, neutrones y electrones. Estos ltimos tienen carga negativa y son los que entran en juego en los enlaces. Estn girando en rbitas alrededor del ncleo del tomo . Los tomos se pueden unir formando un enlace qumico. Los enlaces qumicos son las fuerzas que mantienen unidos a los tomos.Un enlace covalente entre dos tomos se produce cuando estos tomos se unen, para alcanzar el octeto estable, compartiendo electrones del ltimo nivel.Los enlace covalentes estn formados por tomos NO METALICOS. Elementos situados a la derecha en la tabla peridica.Estos tomos tienen muchos electrones en su nivel ms externo (electrones de valencia) y tienen tendencia a ganar electrones ms que a cederlos, para adquirir la estabilidad de la estructura electrnica de gas noble. Los tomos no metlicos no pueden cederse electrones entre s para formar iones de signo opuesto. En este caso el enlace se forma al compartir un par de electrones entre los dos tomos, uno procedente de cada tomo. El par de electrones compartido es comn a los dos tomos y los mantiene unidos, de manera que ambos adquieren la estructura electrnica de gas noble. Se forman as habitualmente molculas: pequeos grupos de tomos unidos entre s por enlaces covalentes. Regla del OctetoLa regla del octeto, tambin llamada ley de Lewis, dice que todos los tomos de los elementos del sistema peridico, tienden a completar sus ltimos niveles de energa con una cantidad de 8 electrones. Son los electrones de la ltima capa, los ms alejados del ncleo, los que tienden a completarse hasta ser un total de 8 electrones y para ello compartirn electrones con otro tomo.Los gases nobles son los nicos no reactivos, por que ya tienen 8 electrones en su ltima capa. Esta combinacin se puede hacer de varias formas, una de ellas es el enlace covalente.Enlace covalente polarSe forma entre tomos de diferentes elementos, y la diferencia de electronegatividad debe ser mayor que 0,4. En este enlace, los electrones son atrados fundamentalmente por el ncleo del tomo ms electronegativo, generando molculas cuya nube electrnica presentar una zona con mayor densidad de carga negativa y otra con mayor densidad de carga positiva (dipolo).Enlace covalente apolar(no polar)Se forma entre tomos iguales o diferentes, y la diferencia de electronegatividad debe ser cero o muy pequea (menor que 0,4). En este enlace, los electrones son atrados por ambos ncleos con la misma intensidad, generando molculas cuya nube electrnica es uniforme.Tipos de enlaces covalentesEnlace simple: es un par electrnico compartido formado por un electrn perteneciente al ltimo nivel de energa de cada tomo y se representa con una lnea. Ejemplos: H-H, Cl-ClEnlace doble: Formado por dos pares electrnicos compartidos, es decir por dos electrones pertenecientes al ltimo nivel de energa de cada tomo y se representa con dos lneas paralelas. Ejemplo:O=OEnlace triple: Formado por tres pares electrnicos compartidos, es decir por tres electrones pertenecientes al ltimo nivel de energa de cada tomo y se representa con tres lneas paralelas. Ejemplo: NNEnlace covalente dativo: Es un par electrnico compartido por dos tomos pero ambos electrones son aportados por el mismo tomo. Se suele representar con una flecha ().