Estructura electrónica de los átomosdepa.fquim.unam.mx/amyd/archivero/Estructura_Electronica...y y...
Transcript of Estructura electrónica de los átomosdepa.fquim.unam.mx/amyd/archivero/Estructura_Electronica...y y...
Química General ISemestre 2010-1
Estructura Atómicars.emnhome.com
Estructura
electrónica de
los átomos
Semestre 2010-1
Grupo 07
J. J. Thompson
E. Rutherford
Química General ISemestre 2010-1
Estructura Atómicars.emnhome.com
1900: Max Planck introduce el concepto de cuanto de
energía.
1905: Albert Einstein explica el efecto fotoeléctrico con
la teoría de Planck.
1913: Neils Bohr describió a los electrones del átomo en
órbitas circulares con el supuesto de que la energía
entre cada órbita está cuantizada.
Química General ISemestre 2010-1
Estructura Atómicars.emnhome.com
1925: Louis de Broglie introduce el concepto de la naturaleza ondulatoria
del electrón.
1926: Erwin Schrödinger describe a los electrones con una ecuación de onda
modificada con las ideas de L. de Broglie, mecánica cuántica.
Esta ecuación describe perfectamente al átomo de hidrógeno que sólo tiene
un electrón.
De la solución a la ecuación de Schrödinger se desprenden los números
cuánticos y los orbitales atómicos.
Química General ISemestre 2010-1
Estructura Atómicars.emnhome.com
Números cuánticos
Número cuántico principal (n)
Describe el nivel principal de energía o capa que ocupa cada electrón.
n = 0, 1, 2, 3,4,….
Número cuántico de momento angular (llll)
Describe la forma específica del orbital atómico que puede ocupar el electrón.
l l l l = 0, 1, 2, 3, 4,…, (n-1)
0 = s
1 = p
2 = d
3 = f
Química General ISemestre 2010-1
Estructura Atómicars.emnhome.com
Número cuántico magnético (mllll)
Designa a un orbital específico en su orientación espacial, pero no en su energía.
ml = (- llll),…,0,…, (+ llll)
Por ejemplo, cuando llll es igual a 1, que designa a la subcapa p, hay tres valores
permisibles de ml : -1, 0, +1. En consecuencia, a una subcapa p están asociadas
tres regiones espaciales distintas, llamadas orbitales atómicos, los cuales se
designan como px, py y pz.
Número cuántico de spín (ms)
Se refiere al giro del electrón y a la orientación de su campo magnético.
ms = ± ½
Los valores de n, llll, mllll y ms describen un orbital atómico en particular.
Cada orbital atómico no puede alojar más de dos electrones, uno con ms = + ½
y otro con ms = - ½
Química General ISemestre 2010-1
Estructura Atómicars.emnhome.com
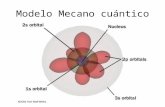
Orbital s (1s)
n = 1
l l l l = 0
ml = 0
ms = ± ½
Orbital p (2p)
n = 2
l l l l = 1
ml = -1, 0, +1
ms = ± ½
Química General ISemestre 2010-1
Estructura Atómicars.emnhome.com
Orbital d (3d)
n = 3
l l l l = 2
ml = -2, -1, 0, +1, +2
ms = ± ½
Química General ISemestre 2010-1
Estructura Atómicars.emnhome.com
Orbital f (4f)
n = 4
l l l l = 3
ml = -3, -2, -1, 0, +1, +2, +3
ms = ± ½
Química General ISemestre 2010-1
Estructura Atómicars.emnhome.com
Configuración Electrónica
La construcción de la configuración electrónica comienza en el estado basalestado basal (estado de
menor energía).
Principio de Principio de AufbauAufbau (Niels Bohr):
1) Los electrones se encuentran en los orbitales atómicos de tal forma que resulte el
estado energético más bajo posible.
2) Los electrones se asignan a orbitales en un orden creciente de n + l
Ejemplo: orbital 2s n = 2 ; l = 0 ; n + l = 2
orbital 2p n = 2 ; l = 1 ; n + l = 3
3) Para subcapas con el mismo valor de n + l , los electrones se asignan primero a la
subcapa con menor valor de n.
Ejemplo: orbital 2p n = 2 ; l = 1 ; n + l = 3
orbital 3s n = 3 ; l = 0 ; n + l = 3
Química General ISemestre 2010-1
Estructura Atómicars.emnhome.com
Todas las estructuras electrónicas de los átomos están regidas por el Principio de Principio de
ExclusiExclusióón de n de PauliPauli.
“Ninguno de los 2 electrones que ocupan un orbital pueden tener los 4 números cuánticos
idénticos.”
Un orbital solamente puede hospedar a 2 electrones como máximo.
Uno de ellos tendrá el número cuántico ms = + ½ y el otro ms = - ½
ms = + ½ ms = - ½
Orbital (n, l, ml)
2 electrones
como máximo
(ms)
Regla de Regla de HundHund: Los electrones ocupan los
orbitales de una subcapa desapareados
antes de aparearse.





























![363n 4 [Modo de compatibilidad])depa.fquim.unam.mx/amyd/archivero/Coordinacion4_1396.pdf · Números cuánticos n Número cuántico principal– gobierna el tamaño y energía de](https://static.fdocumento.com/doc/165x107/5e2066476d08ea1ceb1de3b7/363n-4-modo-de-compatibilidaddepafquimunammxamydarchiverocoordinacion41396pdf.jpg)
