Inserto Urea
-
Upload
emmanuel-arenas -
Category
Documents
-
view
292 -
download
10
Transcript of Inserto Urea

Stanbio UREA (BUN) Liqui-UV®
Para la determinación cuantitativa cinética de Urea (Nitrógeno de Urea (BUN) en suero.
Principio y Resumen. La urea es el principal producto de desecho del catabolismo de proteínas. Es sintetizada en el hígado a partir del amonio, el cual es producido como resultado de la desaminación de aminoácidos. Normalmente, el nitrógeno de urea en la sangre comprende sólo el 45% del nitrógeno no protéico. La importancia de la determinación del Nitrógeno de urea es su valor como buen indicador del funcionamiento hepático y renal. La disminución de los niveles de Nitrógeno de urea (BUN) se ha visto en la nefritis, destrucción hepática aguda, amiloidosis y embarazo1. Valores elevados de BUN se han visto en casos de nefritis aguda y crónica, obstrucción urinaria e intestinal, uremia, envenenamiento por metales, neumonía, enfermedad de Addison, peritonitis, shock en cirugía y fallas cardiacas. El procedimiento Bun de Stanbio es una modificación del método descrito por Sampson1. La urea se convierte catalíticamente a carbonato de amonio por acción de la ureasa. La velocidad de reacción depende de la concentración de deshidrogenasa glutámica. La velocidad de reacción de esta segunda reacción es dependiente de la primera y puede medirse por la velocidad de conversión de NADH a NAD por el cambio de absorbancia a 340 nm.
Urea + H20 ⎯⎯ →⎯Ureasa 2NH4
+ + 2HO3-
2-Oxoglutarato + NH4
+ + NADH L-glutamato + NAD+ + H2O
Reactivos. -Regulador de UREA (BUN) (R1) Composición: Tris, pH 7.8 120 mmol/L 2-Oxoglutarato 7.0 mmol/L ADP (Sal monosódica 0.6 mmol/L Tris Buffer, pH 7.5 80 mmol/L. Ureasa 60000 U/L GLDH (Levadura de pan) 10000 U/L -Enzima UREA (BUN) (R2) Composición: NADH (sal disódica) 0.25 mmol/L. -Estándar de UREA (64.2 mg/dL) - BUN (30 mg/dL) Solución acuosa de urea con trazas de estabilizador. Es estándar esta referido contra material NIST.
Presentaciones Disponibles: Equipo para 100 - 200 pruebas.
Precauciones: Para uso diagnóstico In-Vitro. Tome las precauciones normales para el manejo de reactivos de laboratorio. Los reactivos contienen azida de sodio que puede ser tóxico si se ingiere. Se ha reportado que la azida de sodio puede reaccionar con plomo y cobre de tuberías, pudiendo formar azidas metálicas explosivas. Consulte su hoja de seguridad para más información.
Preparación del reactivo El Buffer y los reactivos enzimáticos líquidos esta listos para su uso. Prepare el reactivo de trabajo en un proporción de 5 partes de Buffer (R1) y 1 parte de enzima (R2), (por ejemplo 25 mL de Buffer y 5 mL de enzima). Antes de utilizarse mantener el reactivo de trabajo a temperatura ambiente 288-298 K (15-25°C) por lo menos 30 minutos.
Estabilidad y almacenamiento del reactivo: Los reactivos son estables hasta su fecha de caducidad marcada en la etiqueta cuando se almacena de 275 a 281 K (2 a 8 °C) y protegidos de la luz. Los reactivos deben verse
claros y sin color. Descartar si se ve turbio ó si contiene partículas. El reactivo de trabajo es estable por 4 semanas de 275 a 281 K (2 a 8°C) o 5 días a temperatura ambiente 288 a 298 K (15 - 25°C). Proteger de la luz directa. El reactivo de trabajo deberá desecharse si la absorbancia inicial, leída contra agua a 340 nm es menor de 1.000.
Materiales requeridos pero no incluidos Espectrofotómetro capaz de realizar lecturas de absorbancia a 340 nm con 1 cm de paso luz. Baño de temperatura constante a 310 K (37ºC) o portacubeta de temperatura controlada. Pipetas serológicas ó automáticas Tubo de ensaye Cronómetro
Recolección y Almacenamiento de la muestra El suero no hemolizado es la muestra de elección. Siempre que sea posible, las muestras deben ser separadas y analizadas el mismo día que se recolectan. Se deben evitar los anticoagulantes que contienen amonio o sales de flúor. La urea en el suero es estable por 24 horas a temperatura ambiente 288 a 298 K (15 - 25°C), varios días si se refrigera de 275 a 281 K (2 a 8 °C) y por lo menos de 2 a 3 meses cuando se congelan a 253 K (-20°C). Niveles de bilirrubina por arriba de 40 mg/dL, hemoglobina por arriba de 200 mg/dL y niveles de triglicéridos por arriba de 2000 mg/dL no muestran interferencia con esta prueba4.
Sustancias Interferentes. Además de la hemólisis, el flúor a concentraciones elevadas y el amonio pueden causar interferencias.3
Procedimiento Manual. 1. Prepare el reactivo de trabajo de BUN de acuerdo al instructivo. 2. Calibre a cero el espectrofotómetro a 340 nm con agua destilada. 3. Por cada Muestra y Control, agregar 1.0 mL. de reactivo de trabajo a la
cubeta o tubo de prueba y llevar a 310K (37°C) por 3 minutos. 4. Adicionar 10 μL (0.010mL) de suero a cada tubo respectivamente y
agitar levemente. 5. Leer y anotar la absorbancia (A1) exactamente después de 30 segundos. 6. Exactamente a los 60 seg después de leer (A1), lea y registre la
absorbancia (A2). 7. Calcule el cambio de absorbancia por minuto (ΔA) mediante la resta de
(A1-A2). 8. Procese las muestras de pacientes y controles siguiendo los pasos del 4 al
7.
NOTA: Si la cubeta no está a temperatura controlada, incube las muestras 310 K (37ºC) entre lectura y lectura. Los volúmenes se pueden duplicar, si el instrumento requiere un volumen mayor de 1 mL.
Control de Calidad. Los sueros control Normal Ser-T- Fy I y Suero Control anormal, Ser- T- Fy II son recomendados en cada ensayo. Otros controles comerciales disponibles con valores de BUN probados por este método también pueden ser utilizados. La concentración de BUN determinada en estos materiales y por este método, deberá caer dentro de los rangos establecidos para los controles. Dos niveles de controles deben ser analizados en cada ensayo.
Calibración. Requiere calibración. Se debe seguir la guía del fabricante del instrumento para calibrar el analizador.
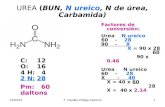
Resultados. Los valores se derivan de la comparación del cambio de absorbancia (ΔA) de la muestra (u) con la del estándar (s).
BUN suero (mg/dL) = ΔAu x 30 ΔAs
Donde Au y As son los cambios de absorbancias (decrementos) de la muestra y del estándar, respectivamente y 30 es la concentración del estándar (mg/dL).
Ejemplo: Δu = 0.045, ΔAs = 0.090
BUN suero (mg/dL) = 0.045 x 30 = 15 0.090
Limitaciones. Si el valor de BUN excede 140 mg/dL, la muestra debe diluirse al doble (1+1), con solución salina, repetir el ensayo y multiplicar los resultados por el factor de
dilución de 2. Los valores de BUN en pacientes neonatos no han sido establecidos con este procedimiento.
Valores Esperados2. Rango normal: BUN 8 -23 mg/dL UREA 17-49 mg/dL UREA (mg/dL) = BUN (mg/dL) x 2.14 UREA (mmol/L) = UREA (mg/dL) x 0.167
El rango deberá servir solamente como guía. Se recomienda que cada laboratorio establezca su propio rango de valores normales ya que existen diferencias entre instrumentos, laboratorio y población local. Características4. Las siguientes características de funcionamiento fueron llevadas a cabo utilizando un Epos 5060.
Comparación. Un grupo de 68 muestras dentro de un rango de BUN de 11 - 97 mg/dL, fue realizado por el método de BUN descrito y por otro similar comercialmente disponible. Con la comparación de resultados se obtuvo un coeficiente de correlación de 0.999 y con una ecuación de regresión de y= 1.012x - 0.47. (La comparación de estudios se llevó a cabo de acuerdo a la guía tentativa NCCLS EP9-T).
Precisión. La precisión intraensayo fue realizada mediante 20 ensayos con tres diferentes niveles de sueros controles comerciales. Los valores de precisión total se obtuvieron por el ensayo de 3 controles comerciales por cinco días consecutivos.
INTER-ENSAYO
Suero 1 Suero 2 Suero 3 Media BUN (mg/dL) 22 45 54 Desviación Std. (mg/dL) 0.6 0.8 0.6 C.V. (%) 2.6 1.8 1.2
PRECISION TOTAL
Suero 1 Suero 2 Suero 3 Media BUN (mg/dL) 15 46 70 Desviación Std. (mg d/L) 0.4 0.6 0.7 C.V. (%) 3.0 1.2 1.0
Se llevaron a cabo estudios de precisión de acuerdo con la guía tentativa de la NCCLS, EP5-T.
Linearidad. Es lineal de 2-140 mg/dL4. De acuerdo a la guía NCCLS EP6-P.
Sensibilidad. En base a la resolución del instrumento de A=0.001, éste método muestra una sensibilidad de 2.0 mg/dL. Los valores por debajo de 2.0 mg/dL deben reportarse como < 2.0 mg/dL.
Referencias. 1. Sampson, E.J., Baird, M.A., Burtis, C.A., et. al.: A coupled-enzyme equilibrium
method for measuring urea in serum: Optimization and evaluation of de AACC Study Group on urea candidate reference method. Clin. Chem., 26, 816-826, 1980.
2. Henry, R.J., Clinical Chemistry Principles and Techniques, 2nd, Edition, Harper and Row, Hagerstown, NY, (1974), p. 511.
3. Tietz, N.W., Textbook of Clinical Chemistry, W.B. Saunders Company, Philadelphia, PA, (1986), p. 1270-1271.
4. Stanbio Laboratory Data.
Fabricado en EUA por: Stanbio Laboratory.
1261 North Main Street Boerne TX, 78006
Distribuido en México por: Laboratorios Licon, S.A. Viveros del Rocío No. 33 Col. Viveros de la Loma Tlalnepantla, Edo. de Méx. C.P. 54080 Tel.: 5-362-02-99 Fax: 5-362-17-92 Rev. 24/12/02
IN-352
⎯⎯ →⎯GLDH