Kernel
-
Upload
miguel-angel-carranza -
Category
Documents
-
view
2.974 -
download
0
Transcript of Kernel

¿Cómo hacer configuraciones
electrónicas de kernel?
Son más sencillas de hacer que las otras configuraciones, es como una versión abreviada utilizando la configuración electrónica de los gases nobles como un centro, corazón, core o kernel electrónico para los elementos químicos. Las reglas a recordar para poder usar la configuración electrónica de kernel para cualquier elemento son muy sencillas.
1) Tienes que usar el gas noble que está en el periodo inmediato superior. 2) El Símbolo químico del gas noble entre corchetes con su número atómico para
representar que ése núcleo o kernel está lleno ([2He], [10Ne], [18Ar], [36Kr], [54Xe], [86Rn]) en lugar de escribir toda la configuración desde el 1s2.
3) Y escribir la estructura electrónica solamente del periodo en que se encuentra el elemento.
4) Es importante recordar que sólo podemos usar los gases nobles enlistados previamente por criterios energéticos, dado que los gases nobles llenan órbitas y todos terminan en p6.
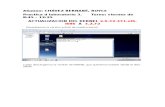
Por ejemplo para el Hierro 26 su configuración electrónica es: 26Fe: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d6
El Hierro está en el 4° periodo, por lo tanto el gas noble que le corresponde en kernel es
el [18Ar], que tiene la siguiente configuración electrónica:
18Ar: 1s2, 2s2, 2p6, 3s2, 3p6
Como verás resaltado en amarillo la configuración del Argón es idéntica a la capa más
interna (y no reactiva) del Hierro, por lo tanto la podemos usar para abreviar la
configuración del Hierro de la siguiente manera:
26Fe: [18Ar] 4s2, 3d6
Y nos queda representada sólo la estructura electrónica del 4° periodo.
Instructor Miguel A. Carranza García Zepeda