pregunta 8 de quiimica
-
Upload
christian-rojas-huillca -
Category
Documents
-
view
217 -
download
1
description
Transcript of pregunta 8 de quiimica
SEMANA N 15
SEMINARIO N II-6: AMINOCIDOS Y PROTENAS. NIVELES ESTRUCTURALES EN PROTENAS
LECTURA RECOMENDADALas amiloidosis humanas: cuando las protenas muestran su lado oscuro.Protenas, redefiniendo algunos conceptos.El caos ordenado de las protenas
TRABAJO EN EQUIPOInvestigue y responda las siguientes preguntas:1. Respecto a los aminocidos:a. Cuntos aminocidos presentes en la naturaleza se han reportado hasta el momento?Hay 22 aminocidos conocidos que se clasifican del siguiente modo.Aminocidos esenciales: son 9 y se llaman as porque no pueden ser fabricados por nuestro cuerpo (el resto si) y deben obtenerse a travs de la alimentacin. Los aminocidos esenciales son la Leucina, Isoleucina, Valina, Triptfano, Fenilalanina, Metionina, Treonina, Lisina e Histidina.Aminocidos no esenciales: son as mismos importantes pero si no se encuentran en las cantidades adecuadas, pueden sintetizarse a partir de los aminocidos esenciales o directamente por el propio organismo. Estos aminocidos son cido Glutmico, Alanina, Aspartato y Glutamina.Aminocidos condicionalmente esenciales: seran esenciales slo en ciertos estados clnicos. As la Taurina, Cistena y la Tirosina suelen ser esenciales en prematuros. La Arginina puede ser tambin esencial en casos de desnutricin o en la recuperacin de lesiones o ciruga. La Prolina, la Serina y la Glicina tambin seran, puntualmente, esenciales.Por ltimo tenemos a la Carnitina que muchos autores tambin incluyen como aminocido aunque es una sustancia sintetizada en nuestro cuerpo a partir de otros aminocidos.b. Cuntos y cules aminocidos formanparte de las protenas?, qu caractersticas tienen en comn?
Cada aminocido contiene un grupo "amino" (NH3) y un "grupo carboxilo" (COOH) . Los aminocidos varian en sus cadenas laterales.
c. Cmo se clasifican los aminocidos segn:el tipo de cadena lateraAminocidos alifticos: En este grupo se encuadran los aminocidos cuya cadena lateral es aliftica, es decir una cadena hidrocarbonada.Aminocidos aromticos: En este grupo se encuadran los aminocidos cuya cadena lateral posee un anillo aromticoAminocidos azufrados: Hay dos aminocidos cuyas cadenas laterales poseen tomos de azufre, son la cistena, que posee un grupo sulfhidrilo, y la metionina, que posee un enlace tioster.Aminocidos hidroxilados: Otros dos aminocidos tienen cadenas alifticas hodroxiladas, la serina y la treonina. El grupo hidroxilo hace de estos aminocidos mucha ms hidroflicos y reactivos.
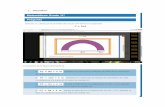
Las propiedades de la cadena lateralNeutros polares, polares o hidrfilos : serina (Ser, S), treonina (Thr, T), cistena (Cys, C), glutamina (Gln, Q), asparagina (Asn, N) , tirosina (Tyr, Y) y glicina (Gly, G).Neutros no polares, apolares o hidrfobos: alanina (Ala, A), valina (Val, V), leucina (Leu, L), isoleucina (Ile, I), metionina (Met, M), prolina (Pro, P), fenilalanina (Phe, F) y triptfano (Trp, W).Con carga negativa o cidos: cido asprtico (Asp, D) y cido glutmico (Glu, E).Con carga positiva o bsicos: lisina (Lys, K), arginina (Arg, R) e histidina (His, H).Aromticos: fenilalanina (Phe, F), tirosina (Tyr, Y) y triptfano (Trp, W) (ya incluidos en los grupos neutros polares y neutros no polares).la capacidad de sntesis del organismoEsenciales; la carencia de estos aminocidos en la dieta limita el desarrollo del organismo, ya que no es posible reponer las clulas de los tejidos que mueren o crear tejidos nuevos, en el caso del crecimiento.No esenciales:A los aminocidos que pueden sintetizarse en el propio organismo se los conoce como no esenciales2. Respecto a niveles de organizacin de las protenas:a. Qu estructuras puede presentar una protena? Explique cada una de ellas.Las protenas puedes presentar 4 tipos de estructura:Estructura primaria: La estructura primaria es la secuencia de aminocidos de la protena. Nos indica qu aminocidos componen la cadena polipeptdica y el orden en que dichos aminocidos se encuentran. La funcin de una protena depende de su secuencia y de la forma que sta adopte.Estructura secundaria: La estructura secundaria es la disposicin de la secuencia de aminocidos en el espacio. Los aminocidos, a medida que van siendo enlazados durante la sntesis de protenas y gracias a la capacidad de giro de sus enlaces, adquieren una disposicin espacial estable, laestructura secundaria. Existen dos tipos de estructura secundaria:1. La a(alfa)-hlice Esta estructura se forma al enrollarse helicoidalmente sobre s misma la estructura primaria. Se debe a la formacin de enlaces de hidrgeno entre el -C=O de un aminocido y el -NH- del cuarto aminocido que le sigue.2. La conformacin beta En esta disposicin los aminocidos no forman una hlice sino una cadena en forma de zigzag, denominada disposicin en lmina plegada. Presentan esta estructura secundaria la queratina de la seda o fibrona.Estructura terciaria: La estructura terciaria informa sobre la disposicin de la estructura secundaria de un polipptido al plegarse sobre s misma originando una conformacin globular. En definitiva, es la estructura primaria la que determina cul ser la secundaria y por tanto la terciaria. Esta conformacin globular facilita lasolubilidad en aguay as realizar funciones detransporte, enzimticas, hormonales, etc.Estructura cuaternaria: Esta estructura informa de la unin, mediante enlaces dbiles (no covalentes) de varias cadenas polipeptdicas con estructura terciaria, para formar un complejo proteico. Cada una de estas cadenas polipeptdicas recibe el nombre de protmero.
b. Qu fuerzas estabilizan la estructura tridimensional de una protena?La estructura de las protenas est estabilizada por diferentes tipos de enlaces, como enlaces covalentes (enlace peptdico, enlace por puentes disulfuro), enlaces por puentes de hidrgeno (interacciones dipolo-dipolo), interacciones hidrofbicas, enlaces salinos (interacciones electrostticas) o las fuerzas de los contactos de Van der Waals. Todos estos tipos de enlaces juegan un importante papel en la estabilizacin de la estructura tridimensional de las protenas.3. Qu condiciones afectan el plegamiento correcto de las protenas?
4. Cmo est formado el sistema de control de plegamiento en los organismos?
5. Qu es la amiloidosis?Amiloidosis es un trmino genrico, utilizado para hacer referencia a un grupo de enfermedades de etiologa diversa y pronstico y tratamiento variables, con una caracterstica comn: todas ellas estn causadas por el Depsito extracelular de un material, denominado material amiloide. Este material, de naturaleza proteica, insoluble y resistente a la protelisis, fue bautizado por Virchow debido a su afinidad por colorantes yodados, similar a la del almidn.
6. A qu se denomina precursor amiloide?
7. Cules son las caractersticas generales de los amiloides?Es un nombre genrico para designar diversas sustancias que tienen en comn estar contituidas por protena fibrilar b-plegada. Este tipo de estructura no ocurre normalmente en las protenas de los mamferos. En nombre de amiloide, dado por Virchow, se debe a la similitud con el almidn en cuanto a la afinidad tintorial con el yodo.El amiloide es una sustancia: amorfa, hialina y eosinfila.Se tie con cristal violeta o violeta de metilo y adquiere una coloracin violeta a rosa.Produce una fluorescencia secundaria con luz ultravioleta cuando se tie con las tioflavinas T o S.Se tie con rojo congo. Bajo luz normal aparece teido de color rosado a rojo. Bajo luz polarizada presenta una birrefringencia verde (se debe a la configuracin en hoja plegada de las fibrillas).Se observan largas fibrillas no ramificadas de longitud indefinida y con dimetro variable entre 7.5 y 10 nm.Son protenas muy heterogneas y se depositan en cuadros clnicos distintos, 95% protenas fibrilares y 5% componente amiloide-P del suero.
7.Culessonlascaractersticasgeneralesdelosamiloides?El material amiloide es de origen proteico, insoluble y resistente a la protelisis.El material amiloide est formado en un 95% por fibrillas de amiloide.El otro 5% del material amiloide corresponde a factores que, probablemente, contribuyena la estabilizacin de las fibrillas, de los cuales los ms importantes son el componentesrico P (una molcula de la familia de las pentraxinas, muy similar a la protena Creactiva) y proteoglucanos y glicosaminglicanos, procedentes de la matriz extracelular deltejido de depsito
8.Mencionelasestructurasproteicasinvolucradasenlasamiloidosishumanasconocidas?Amiloidosis es el estado de una protena quese encuentra en condiciones deestrsfsico, qumico y funcional que enfrentan tanto en el interiorcomo en el exterior dela clula.Se ha demostrado que numerosas enfermedades humanas y de los animales,reunidas bajo el trmino de amiloidosis, estn asociadas a alteraciones delplegamiento de un grupo particular de protenas que se depositan en el espacioextracelular enformadeagregados fibrilaresinsolubles; siendo estos losformadores de los amiloides.En ciertas circunstancias, las protenas pueden formar agregados que son muydiversos, tanto por su morfologa al microscopio electrnico como por su ordeninterno. Estas diferencias se reflejan en sus propiedades bioqumicas y en sucapacidad para interactuar, con muy diversas consecuencias, con diferentesestructuras y componentes celulares
9. Qu modelos se postulan para el posible mecanismo de conversin del estado nativoal estado fibrilar de una protena amiloidea?HIPOTESISSOBREELPLEGAMIENTODEPROTEINAS(I)Paradoja de LevinthalDebido a los grados de libertad de una cadena polipeptdica, encontrar el estado nativode una protena mediante bsqueda aleatoria entre todas las configuraciones posiblesllevara muchsimo tiempo, mientras que las protenas se pliegan en nanosegundos.EjemploPolipptido de 100 Si cada pudiera adoptar 2 conformaciones (rotacion de los angulos y ), sin tenerencuenta las conformaciones de las cadenas laterales:2100 1030 conformacionesSi la interconversin entre dos conformaciones durase 10-12s:Tiempo para que ocurra el plegamiento: 1030 * 10-12 = 1018s 1010 aosHIPTESISSOBREELPLEGAMIENTODEPROTENAS(II)Consecuencia:El plegamiento de protenas no puede tener lugar por un proceso de prueba y error (trial& error).Solucin a la Paradoja de LevinthalEl plegamiento de protenas est guiado por la formacin de interacciones locales entreaminocidos que actan como ncleos de plegamiento. Prueba a favor de esta hiptesis.Se han encontrado estados intermedios en el plegamiento de una protena.HIPTESISTERMODINMICA:DOGMADEAFISEN.AutoensamblamientoLa estructura nativa de una protena viene determinada por su secuencia de aminocidos,es nica, estable y se corresponde con un mnimo de energa libre.Hiptesis vlida para protenas globulares.EjemploLa ribonucleasa pancretica presenta 4 puentes disulfuro (Cys26 -Cys84, Cys58 -Cys110, Cys40 - Cys95 & Cys65-Cys72).Desnaturalizacin con urea y mercaptoEtOH: se reducen los enlaces disulfuro.Renaturalizacin progresiva: se forman los enlaces disulfuro correctos. La RNasapancretica se renaturaliza espontneamente.