PROTEÍNAS
-
Upload
adahi-gallardo-zugarazo -
Category
Documents
-
view
316 -
download
6
Transcript of PROTEÍNAS

PROTEÍNAS:Son los materiales con los que están constituidos los seres vivos.Están constituidas por carbono, nitrógeno, hidrógeno y oxígeno, se les agrega generalmente fósforo y azufre.

FUNCIONES:• Se encargan de catalizar las reacciones que se producen en el
organismo (enzimas).• Regular procesos metabólicos (hormonas). • Transportar el oxígeno (hemoglobina). • Proporcionan medios de protección al organismo (anticuerpos).• Otorgan al cuerpo los medios de movimientos (músculos y tendones).

NATURALEZA QUÍMICA:
Las proteínas están constituidas por unidades (monómeros) llamadas aminoácidos, constituidos por átomos de carbono, hidrógeno, nitrógeno y oxígeno; aparte de estos átomos se les agregan azufre y fósforo.

ESTRUCTURA:Cada molécula de proteína tiene una forma tridimensional definida llamada conformación.La conformación de una proteína se divide en cuatro niveles de organización: primaria, secundaria, terciaria y cuaternaria.
PRIMARIA: Es la más importante y está relacionada con la secuencia de aminoácidos en la cadena polipéptica. Las proteínas que poseen esta estructura tienen una cadena abierta polipéptida de aminoácidos, con un grupo amino (NH2) inicial y un grupo carboxilo (COOH) terminal.

SECUNDARIA:Presenta conformaciones extendidas o arrolladas en espiral de las cadenas polipépticas, como las proteínas fibrosas. Se presentan en formas distintas:
Alfa hélice: Los enlaces de hidrógeno de esta estructura se prolongan desde los átomos de oxígeno del grupo carbonilo hasta los átomos de hidrógeno a lo largo de todo el esqueleto polipéptido. La configuración helicoidal de la cadena polipéptida permanece rígida debido al puente de hidrógeno.
Beta lamina plegada:Consiste en un arreglo lado a lado de las moléculas de un polipéptido tiende a adquirir la forma de una hoja plegada, en la que los enlaces de hidrógeno unen las cadenas.

Tipo colágeno: Consiste en un súper enrollamiento triple de la cadena de las unidades de polipéptido. Cada cadena tiene aproximadamente 1,000 residuos de aminoácidos, estos se tuercen para construir una triple hélice, de tal forma que cada cadena está dispuesta en una hélice abierta, en la cual las hélices se enrollan una a otra hasta constituir un cable helicoidal súper enrollado.
TERCIARIA: Está consiste en un súper enrollamiento o torcedura posterior de las estructuras secundarios capaz de producir una estructura rígida, tal como la estructura terciaria de la mioglobina, que contiene 153 aminoácidos.
CUATERNARIA:Está representada por el acoplamiento de varias cadenas polipeptídicas, iguales o diferentes, con estructuras terciarias (protómeros) que quedan auto ensambladas por enlaces débiles, no covalentes. Esta estructura no la poseen, tampoco, todas las proteínas. Algunas que sí la presentan son: la hemoglobina y los enzimas alostéricos.

CLASIFICACIÓN: SEGÚN SU COMPOSICIÓN:Proteínas simples u Holoproteínas: Las cuales están formadas exclusivamente o predominantemente por aminoácidos.
Proteínas conjugadas: Poseen un componente de proporción significativa no aminoacídico que recibe el nombre de grupo prostético. Según la naturaleza de este grupo consideramos:
Lipoproteínas • Proteínas conjugadas con lípidos
que se encuentran en las membranas celulares.
Glicoproteínas • Su estructura posee azucares.
Ejemplo: las inmunoglobulinas, algunas proteínas de membrana, el colágeno y otras proteínas de tejidos conectivos (glucosaminoglicanos).
Nucleoproteínas • Se presentan unidas a un
ácido nucleico, como en los cromosomas, ribosomas y en los virus.
Metaloproteínas • Contienen en su molécula
uno o más iones metálicos que no constituyen un grupo hem. Por ejemplo algunas enzimas.
Hemoproteínas o Cromoproteínas• Proteínas que tienen en su
estructura un grupo hem. Ejemplos: Hemoglobina, Mioglobina y ciertas enzimas como los citocromos.

DE ACUERDO CON SU MORFOLOGÍA Y SOLUBILIDAD:
Proteínas fibrosas
Son insolubles en agua.
Presentan formas moleculares alargadas, con un número variado de cadenas polipeptídicas que constituyen fibras resistentes, con cierto grado de elasticidad, fragilidad o ductilidad.
Funcionan como proteínas estructurales o de soporte. Las más comunes son: Elastina, Colágeno, Queratina, Fibrina, etc.

Proteínas globulares Tienden a ser más solubles en agua, debido a que su superficie es polar, también pueden presentar mayor
solubilidad en otros solventes (soluciones salinas, ácidos o bases
diluidas o alcohol). Estructura compacta con formas casi esféricas.
La mayoría de las proteínas conocidas son globulares (dentro de
las que se consideran todas las enzimas, las proteínas del plasma y
las presentes en las membranas celulares).
Albúminas: Proteínas fácilmente solubles en agua, que coagulan con el calor y precipitan con las soluciones salinas saturadas. Por ejemplo la Lactoalbúmina, albúmina del suero, la ovoalbúmina (presente en la clara del huevo).
Globulinas: Escasamente solubles en agua pura, pero solubles en soluciones salinas diluidas como cloruro de sodio, entre ellas se encuentran las seroglobulinas (sangre), ovoglobulina, inmunoglobulinas, etc.
A su vez las proteínas globulares se pueden clasificar de acuerdo con su solubilidad:
Prolaminas: Solubles en alcohol del 70 al 80%, insolubles en agua, alcohol absoluto y otros solventes neutros, como la Zeína del maíz y la Gliadina del trigo.
Glutelinas: Solubles en ácidos y bases diluidos, insolubles en solventes neutros. Ejemplo: La Glutenina del trigo.

DE ACUERDO CON SU FUNCIÓN BIOLÓGICA: Proteínas estructura
les • Forman parte de
células y tejidos a los que confieren apoyo estructural.
• El colágeno y la elastina presentes en el tejido conectivo de los vertebrados.
• La queratinas de la piel, pelo y uñas y la espectirna presente en la membrana de los eritrocitos.
Proteínas de
transporte • Transportan
sustancias como el oxígeno en el caso de la hemoglobina y la mioglobina, ácidos grasos en el caso de la albúmina de la sangre, o las que realizan un transporte transmembrana en ambos sentidos.
Proteínas de
defensa • Protegen al
organismo contra posibles ataques de agentes extraños.
• Las proteínas interferones inhiben la proliferación de virus en células infectadas e inducir resistencia a la infección viral en otras células, el fibrinógeno de la sangre importante en el proceso de coagulación.
Proteínas hormonale
s• Se sintetizan en
un tipo particular de células pero su acción la ejercen en otro tipo.
• Ejemplo: la insulina.

• Función consiste en estimular la velocidad de crecimiento y la división celular.
• Como ejemplo se puede citar la hormona de crecimiento y el factor de crecimiento derivado de plaquetas.
Proteínas como
factores de crecimiento
• Permiten aumentar la velocidad de las reacciones metabólicas, dentro de las células son variadas y se encuentran en cantidad considerable para satisfacer adecuadamente sus necesidades.
• Entre otras se consideran las enzimas proteolíticas cuya función es la degradación de otras proteínas, lipasas, amilasas, fosfatasas, etc.
Proteínas catalíticas
o enzimas
• Son capaces de modificar su forma, dando la posibilidad a las células o tejidos que estén constituyendo de desplazarse, contraerse, relajarse razón por la cual se encuentran implicadas en los diferentes mecanismos de motilidad.
• Las proteínas más conocidas de este grupo son la actina y la miosina.
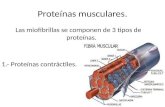
Proteínas contráctiles

•Son las encargadas de combinarse con una sustancia específica, si se encuentran en la membrana plasmática, son las encargadas de captar las señales externas o simplemente de inspeccionar el medio, si encuentran en las membranas de los organelos, permiten su interacción; sin embargo, no son proteínas exclusivas de membrana ya que algunas se encuentran en el citoplasma.
•El ejemplo más típico de éstas son los receptores de las hormonas esteroides. Casi todos los neurotransmisores, la mayoría de las hormonas y muchos medicamentos funcionan gracias a la presencia de estas proteínas.
Proteínas receptoras
• Son proteínas integrales de membrana, comunes en las mitocondrias y cloroplastos cuya función se basa en el transporte de electrones desde un donador inicial hasta un aceptor final con liberación y aprovechamiento de energía.
• Como ejemplo se citan a los citocromos que hacen parte de la cadena respiratoria.
Proteínas de
transferencia de
electrones

REACCIONES: • Con los ácidos minerales concentrados, realizan hidrólisis
proteínica, originando diversos tipos de aminoácidos.
• Con los álcalis no hay precipitaciones de proteínas, pero si se origina hidrólisis y descomposición oxidativa.
• Al reaccionar las proteínas con metales pesados hay precipitación de proteínas y formación de electrolitos.
• Con la presencia de los ácidos las proteínas producen cambios en el pH de los aminoácidos restantes, permitiendo que las proteínas alcancen su punto isoeléctrico.
• Entre 38° a 75°C las proteínas se coagulan en su punto isoeléctrico.

También existen algunas formas de identificar las proteínas atreves de sus reacciones coloridas, entre las formas de identificación tenemos:
• Prueba del millón: consiste en agregar una mescla de nitrito y nitrato de mercurio. Está prueba permite demostrar que la muestra proteínica contiene tirosina, si la prueba da positivo, poco a poco se tiñe de color rojo.
• Prueba de Biuret: consiste en añadir un álcali más dos o tres gotas de una sal débil, está prueba permite la identificación de enlaces peptídicos, dependiendo del tipo de proteína que se analice el color será azul o rosa .
• Prueba Xantoproteíca: consiste en tratar la muestra proteínica con ácido nítrico concentrado, precipitándose la proteína y tomando un color amarillo-limón.

• Reacción de Hopkins-Cole: se agrega un poco de ácido glioxílico y cierta cantidad de ácido sulfúrico concentrado, apareciendo así, un anillo violeta en la zona donde la mescla hiso contacto; con esta prueba se identifica el aminoácido triptófano.
• Prueba de la Ninhidrina: está prueba permite valorar los aminoácidos y consiste en calentarlo junto con dos equivalentes de ninhidrina, así aparece un color azul si tienen aminos libres, mientras que la prolina e hidroxiprolina dan derivados de color amarillo.
• Prueba de Diazo-Ehrlich: se utiliza el nitrito de sodio en una solución con ácido sulfanílico disuelto en ácido clorhídrico, después se alcaliza con hidróxido de amonio, aparece una coloración naranja. Está prueba permite la identificación de la histidina o tirosina.

DESNATURALIZACIÓN:Consiste en la pérdida de la estructura terciaria, por romperse los puentes que forman dicha estructura. Todas las proteínas desnaturalizadas tienen la misma conformación, muy abierta y con una interacción máxima con el disolvente, por lo que una proteína soluble en agua cuando se desnaturaliza se hace insoluble en agua y precipita.
La desnaturalización se puede producir por cambios de temperatura, ( huevo cocido o frito ), variaciones del pH. En algunos casos, si las condiciones se restablecen, una proteína desnaturalizada puede volver a su anterior plegamiento o conformación, proceso que se denomina renaturalización.

IMPORTANCIA BIOLÓGICA DE LAS PROTEÍNAS:
El conjunto de los aminoácidos esenciales sólo está presente en las proteínas de origen animal.
En la mayoría de los vegetales siempre hay alguno que no está presente en cantidades suficientes.
Se define el valor o calidad biológica de una determinada proteína por su capacidad de aportar todos los aminoácidos necesarios para los seres humanos.
La calidad biológica de una proteína será mayor cuanto más similar sea su composición a la de las proteínas de nuestro cuerpo. De hecho, la leche materna es el patrón con el que se compara el valor biológico de las demás proteínas de la dieta.

Por otro lado, no todas las proteínas que ingerimos se digieren y asimilan.
La utilización neta de una determinada proteína, o aporte proteico neto, es la relación entre el nitrógeno que contiene y el que el organismo retiene.
Hay proteínas de origen vegetal, como la de la soja, que a pesar de tener menor valor biológico que otras proteínas de origen animal, su aporte proteico neto es mayor por asimilarse mucho mejor en nuestro sistema digestivo.