¿Son las células mioepiteliales las responsables del ...
Transcript of ¿Son las células mioepiteliales las responsables del ...

216
Artículo de revisión
Patología 2018 jul;56(3):216-28
¿Son las células mioepiteliales las responsables del carcinoma mamario invasor? Estructura y características inmunohistoquímicas generales de las células mioepiteliales y su interrelación en el carcinoma de la glándula mamaria
Are myoepithelial cells responsible for invasive mammary carcinoma? Structure and general immunohistochemical characteristics of myoepithelial cells and their interrelation in carcinoma of the mammary gland
Ivonne Ruiz-Delgadillo,1 Carlos Ortiz-Hidalgo1,2
1 Departamento de Biología Celular y Tisular, Escuela de Medicina, Universi-dad Panamericana, Ciudad de México. 2 Departamento de Anatomía Patoló-gica, Hospital y Fundación Médica Sur, Ciudad de México.
Recibido: 13 de noviembre 201. Aceptado: 16 de noviembre 2018
CorrespondenciaCarlos Ortiz Hidalgo [email protected]
Este artículo debe citarse como Ruiz-Delgadillo I, Ortiz-Hidalgo C. ¿Son las células mioepiteliales las responsables del carcinoma mamario invasor? Estructura y características inmunohistoquímicas generales de las células mioepiteliales y su interre-lación en el carcinoma de la glándula mamaria. Patología Rev Latinoam. 2018;56(3):216-28.
Resumen
La glándula mamaria está formada por 15 a 25 lóbulos compuestos por glándulas aci-nares tubulares y su epitelio está constituido por una capa interna de células secretoras luminales cuboidales o columna baja, rodeada por una capa de células mioepiteliales que descansan sobre una lámina basal. Las células mioepiteliales se asemejan a las células del músculo liso, pero también tienen características de células epiteliales puesto que contienen filamentos intermedios de citoqueratina. Las células secretoras luminales sintetizan los componentes de la leche que va hacia la luz de los alvéolos y conductos y es transportada al pezón como resultado de la contracción de las células mioepiteliales a través de la estimulación de la oxitocina. Las células mioepiteliales también participan en la morfogénesis de la glándula mamaria, modulan la prolifera-ción y diferenciación de las células luminales y participan en la formación de la matriz extracelular secretando proteinasas y sus inhibidores. Además, actúan como supresoras naturales del cáncer porque estabilizan la proliferación de las células luminales pues secretan varias proteínas supresoras, lo que limita el crecimiento de las células can-cerosas, la invasión y la neovascularización. Sobre estas bases funcionales, las células mioepiteliales se han denominado “supresores naturales de tumores”.
PALABRAS CLAVE: Células mioepiteliales; carcinoma mamario; carcinoma in-situ; inmunohistoquímica.
Abstract
The human mammary gland is made up of 15-25 lobes composed of tubular acinar glands the epithelium of which is constituted of an inner layer of cuboidal or low colum-nar luminal secretory cells, surrounded by a layer of myoepithelial cells (MECs) with its basal lamina. MECs resemble smooth muscle cells but also show features of epithelial cells containing cytokeratin intermediate filaments. Luminal secretory cells synthesize milk components, which are collected in alveoli and duct lumen, and transported to the nipple as a result of MECs contraction, through the stimulation of oxytocin. MECs are also involved in mammary gland morphogenesis, modulating proliferation and differentiation of luminal cells and participate in the formation of extracellular matrix, secreting proteinases and their inhibitors. Furthermore, MECs act as natural cancer suppressors because they stabilize luminal cells proliferation as they secrete various suppressor proteins, thus limiting cancer growth, invasiveness, and neoangiogenesis. Based on these functions, MECs have been called “natural tumor suppressors”.
KEY WORDS: Myoepithelial cells; Breast carcinoma; Carcinoma in-situ; Immunohis-tochemistry
w w w . r e v i s t a p a t o l o g i a . c o m
Patología Revista Latinoamericana

217
Ruiz Delgadillo I y col. Estructura y características de las células mioepitelialesw w w . r e v i s t a p a t o l o g i a . c o m
Patología Revista Latinoamericana
Introducción y estructura general de la glándula mamaria
En el mundo, el carcinoma de la glándula ma-maria es el tipo de cáncer más frecuente que afecta a las mujeres. De acuerdo con datos de la Organización Panamericana de la Salud (OPS), en el continente americano, el cáncer mamario es el más común entre las mujeres (29% respecto del total de casos de cáncer) y es la segunda causa de muerte por tumores ma-lignos para este grupo de población, superada únicamente por el cáncer de pulmón (15 contra 18 por ciento).1 Se estima que para el año 2030 habrá más de 596,000 casos nuevos y más de 142,100 muertes en América Latina y el Caribe.1 En México, en el 2016, el INEGI informó que hubo 16 defunciones por cada 100,000 mujeres de 20 o más años causadas por el cáncer de la glándula mamaria y que éste corresponde a la tercera causa de mortalidad en mujeres por tumores malignos.2 El diagnóstico temprano del carcinoma de la glándula mamaria ha reducido, en general, la mortalidad, por lo que es necesario comprender mejor la biología e histopatología de la progresión de esta neoplasia y utilizar este conocimiento para el diseño de opciones terapéuticas moleculares específicas.3
La glándula mamaria es una glándula exocrina túbulo-alveolar ramificada que se considera glándula sudorípara modificada porque libera proteínas de forma merócrina y lípidos de forma apocrina.3 Está formada por 15 a 20 glándulas individuales (lóbulos glandulares) separados por colágena densa, que es la que mantiene en su posición a la mama. Esta colágena discurre entre la piel hasta la aponeurosis del pectoral mayor proporcionando un armazón fibroso que sostiene a los lóbulos mamarios, y se llama “ligamento suspensor de Cooper” en honor al médico inglés Sir Astley Paston Cooper (1768-1841), quien fue el primero en describirlo.4
Cada lóbulo mamario está compuesto por un sistema de conductos ramificados que se inician en la profundidad de la glándula mamaria, en estructuras glandulares conocidas como “unida-des lobulares ductales terminales” (TDLUs por sus siglas en inglés Terminal duct lobular units) de donde salen conductos (intralobulillares) que desembocan a un conducto excretor (conducto galactóforo) que, antes de llegar al pezón se dilatan (seno galactóforo), para finalmente lle-gar al pezón por medio del conducto excretor mamario.3
El crecimiento de la glándula mamaria comien-za durante la pubertad y el embarazo, que es cuando este proceso es estimulado por diversas hormonas ováricas e hipofisiarias: estrógenos, progesterona, lactógenos placentarios, prolac-tina y oxitocina. La glándula mamaria presenta dos fases; 1) en reposo o glándula no lactante y 2) glándula mamaria lactante. En la segun-da mitad del ciclo menstrual, el cuerpo lúteo produce progesterona, que es la que estimula la producción de células epiteliales de los con-ductos terminales e inician la actividad secretora. Si hay embarazo, persiste la producción de progesterona que mantiene la secreción de las unidades terminales ducto-alveolares. Si no hay fecundación, al disminuir la producción de pro-gesterona, la estructura del lobulillo mamario se reduce y disminuye la actividad secretora. Cuan-do la glándula mamaria se encuentra en reposo se encuentra compuesta solo por conductos sin desarrollo de la unidad terminal ducto alveolar.3
El epitelio de los conductos y los alvéolos se-cretores está formado por tres capas de células funcionales inmuofenotpícamente diferentes: 1) una capa de células luminales, que son las responsables de la síntesis y secreción de los diversos componentes de la leche, 2) una capa externa de células mioepiteliales y 3) una capa de células basales que posiblemente correspon-dan a células madre (Stem cells).5,6,7 Se ha podido

218
Patología Revista latinoamericana Volumen 56, Núm. 3, julio-septiembre, 2018
hacer evidente la transición entre células basales y células mioepiteliales diferenciadas, pero no se ha descrito la transición de estas células hacia células diferenciadas luminales.8
Por su composición celular citoplásmica, rica en actina, las células mioepiteliales tienen ca-pacidad de contracción, por eso participan en el proceso de eyección de leche y contribuyen a los diversos procesos fisiológicos: regulación del crecimiento, desarrollo y diferenciación de la glándula mamaria, y en el importante control de la proliferación de células luminales (vide infra).6 En las últimas décadas, el punto principal de la investigación del carcinoma mamario se ha centrado en la célula luminal tumoral ductal o lobular, mientras que el papel de las células mioepiteliales y del microambiente celular pe-ritubular no se ha explorado tan ampliamente.9
En esta revisión se exponen las características histológicas, inmunohistoquímicas y funciona-les de las células mioepiteliales de la glándula mamaria, y se discute el papel que juegan en el carcinoma mamario como reguladoras clave de la transición del carcinoma in situ al carcinoma invasor. Comprender las funciones de las células mioepiteliales durante la progresión tumoral qui-zá pueda conducir a la identificación de nuevos blancos terapéuticas en el carcinoma mamario.
Características generales de las células mioepiteliales en la glándula mamaria
Las células mioepiteliales derivan del ectodermo y están distribuidas a lo largo de los conductos excretores, ordenadas en una capa continua. En las unidades terminales ducto-alveolares forman una red periférica que simula el “entretejido de una canasta”.3 Las células mioepiteliales varían en morfología: en ocasiones, son planas, apenas distinguibles, con núcleos comprimidos, otras veces son muy prominentes, con morfología epi-telioide y abundante citoplasma claro-eosinófilo.
En otras ocasiones son fusiformes, con abundan-te citoplasma eosinófilo, que semeja músculo liso. Por microscopia electrónica, los núcleos de las células mioepiteliales son redondos a ovales, con cromatina dispersa y nucléolos pequeños. En el citoplasma perinuclear se identifican cisternas de retículo endoplásmico rugoso con numerosos ribosomas, aparato de Golgi bien desarrollado, numerosas mitocondrias, múltiples vacuolas, vesículas y filamentos contráctiles. Las células mioepiteliales están unidas entre sí por medio de uniones celulares, tipo nexo, y algunas otras moléculas de adhesión intercelular. Las células luminales están unidas por medio de desmoso-mas (zonula adherens), y la membrana basal por hemidesmosomas.6-10 En la unión entre células mioepiteliales y células luminales participan la P-cadherina (que es componente de las células mioepiteliales) y la E-cadherina (que es com-ponente de las células luminales). Las células mioepiteliales descansan sobre una membrana basal que es producida por ellas mismas, y está compuesta por una combinación de: colágena IV, fibronectina, laminina, entactina, nidogeno y diversos glicosaminoglicanos y proteoglicanos.9
La capacidad contráctil de las células mioepi-teliales deriva del hecho de que su citoplasma contiene numerosas proteínas contráctiles como α-actina de músculo liso, cadenas pesadas de miosina, α-actinina, vinculina, y calponina y filamentos de miosina. Así mismo, tienen características de células basales del epitelio estratificado, y su citoplasma contiene diversas citoqueratinas tipo basal como CK5, CK14, y CK17, que forman una red alrededor del núcleo que se extiende hacia la superficie de la célula y participa en la formación de desmosomas y hemidesmosomas (en particular la CK5 y CK14). La membrana plasmática posee numerosas caveolas, que son pequeñas invaginaciones en forma de bulbo de la membrana plasmática de aproximadamente 50-100 nanómetros, cuya función es el almacenamiento extracelular de

219
Ruiz Delgadillo I y col. Estructura y características de las células mioepitelialesw w w . r e v i s t a p a t o l o g i a . c o m
Patología Revista Latinoamericana
iones de calcio y funcionan, también, como mediadoras del transporte de moléculas entre las células luminales y la matriz extracelular.11
Además de su función contráctil, al unirse con las células luminales, las células mioepiteliales controlan muchos aspectos de su función: flujo de líquidos y electrólitos, así como la entrada y salida de nutrientes y algunos factores de creci-miento. Las células epiteliales luminales también participan en la correcta polaridad, quizá a través de la producción de laminina-1.10,11 Otra función que se le atribuye a las células mioepiteliales es la formación de una barrera estructural entre el estroma y la luz. Por su ubicación, es lógico pensar que las células tumorales luminales de la glándula mamaria solo pueden invadir el estroma después de que irrumpen las células mioepitelia-les y su membrana basal (Figura 1).10,11
Por inmunohistoquímica (como será detallado en párrafos posteriores-vide infra) las células mioepiteliales pueden hacerse evidentes con proteína S-100, actina, calponina, miosina de músculo liso, CD10 (CALLA), receptor del factor
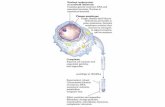
Figura 1. La glándula mamaria normal (A) está constituida por una capa de células luminales, y una externa de células mioepiteliales que descansan en una membrana basal. Diversas alteraciones genéticas de las células mioepiteliales mamarias pueden afectar el desarrollo de ésta, incluyendo los compartimentos estromal y luminal. (B) La alteración y pérdida de células mioepiteliales afecta a las células luminales y la producción de membrana basal, lo que deja libre para la invasión de células tumorales luminales.
de crecimiento nervioso p75 NGF, nestina y D240 (podoplanina).12-15 Además, expresan citoquerati-nas de alto peso molecular como CAM5.2, CK14 y CK17; sin embargo, la CK14 está restringida a las células mioepiteliales de los conductos ma-yores y terminales, y es negativa en las células mioepiteliales de los conductos intralobulares y en los acinos.12,15 Las células mioepiteliales tienen receptores de oxitocina, de integrinas β4 y α1, del factor de crecimiento epidérmico (EGF) y del factor de crecimiento fibroblástico-2 (FGF-2), que funcionan en la regulación del crecimiento celular. También se ha demostrado expresión de activina, que es una proteína dimérica pertene-ciente a la superfamilia del factor de crecimiento transformante β (TGF- β), que contribuye a la regulación del crecimiento de los conductos ma-marios, y expresa igualmente diversas proteínas supresoras de tumores que incluyen p63, p73, 14-3-3 sigma, maspina, y la proteína de tumor de Wilms, lo que sugiere fuertemente la función de supresión tumoral de las células mioepiteliales (vide infra).11,16,17
Las células mioepiteliales participan en la con-tracción de la unidad terminal ducto-alveolar durante la eyección de la leche en la lactancia, que es mediada por la liberación de oxitoci-na. Quizá tanto el péptido relacionado con la paratiroides (PTHrP- por sus siglas en inglés: parathormone related peptide) como el óxido nítrico participan a la par en la modulación de la contracción de las células mioepiteliales. Estos dos elementos son sintetizados por las cé-lulas luminales y por las células mioepiteliales y actúan en forma autocrina y paracrina.16,18 La ubicación de las células mioepiteliales entre las células luminales y la matriz extracelular sugiere que posiblemente estas tengan un papel activo en el intercambio de información entre la matriz extracelular y el epitelio luminal de la glándula mamaria.19
La descripción anterior se refiere a las células mioepiteliales diferenciadas; sin embargo,

220
Patología Revista latinoamericana Volumen 56, Núm. 3, julio-septiembre, 2018
recientemente se identificaron células mioepi-teliales que carecen de expresión de actina α-de músculo liso y algunas de ellas también de citoqueratinas CK 5, 14 y 17, cuya función se desconoce.20
Inmunohistoquímica en el diagnóstico del carcinoma mamario y su relación con las células mioepiteliales
Numerosos estudios in vivo e in vitro han de-mostrado que el crecimiento, la supervivencia, la polaridad y el comportamiento invasor de las células del carcinoma mamario pueden ser re-gulados por las células mioepiteliales y diversas células estromales, y distintos genes de todas estas células se han implicado en este proceso.9,21 Se ha sugerido que las células mioepiteliales son las supresoras naturales del carcinoma mamario pues se ha demostrado que inhiben el creci-miento de tumores, la neoangiogénesis, inducen apoptosis, y limitan la movilidad de las células neoplásicas mamarias.6 Estos efectos han sido, en gran parte, atribuidos a factores paracrinos secre-tados por las células mioepiteliales que ejercen sus efectos en las células ductales suprayacentes. Algunos de estos factores incluyen proteínas pro-pias de las células mioepiteliales, inhibidores de proteasa y diversos factores de crecimiento como el factor de crecimiento epidérmico (EGF) y el TGF-β.6,21 Estudios in vitro han confirmado que estos efectos anti-invasores y anti-proliferativos de las células mioepiteliales aumentan después del tratamiento con tamoxifeno debido a que hay mayor secreción de maspina y producción de óxido nítrico sintasa (iNOS), efectos que son mediados por receptores de estrógenos.22 Aun-que las células mioepiteliales son negativas para los receptores de estrógenos-α (ERα), sí expresan receptores de estrógenos-β (ER-β), y la inducción de maspina e iNOS por las células mioepiteliales parece estar mediado por la activación del factor de transcripción proteína activadora 1 (AP-1) de-pendiente de ER-β. Lo que queda es determinar
si este efecto del tamoxifeno también se observa in vivo y si contribuye a los efectos preventivos atribuidos a los anti-estrógenos.22
Durante la progresión del carcinoma in situ hacia el carcinoma mamario disminuye el número de células mioepiteliales, y cuando el cáncer es invasor, los conductos están casi totalmente desprovistos de células mioepiteliales.19 (Figura 1) De aquí que el principal criterio diagnóstico en patología que se utiliza para diferenciar carcinoma in situ del carcinoma invasor es la presencia o ausencia de la capa de células mioepiteliales, que se confirma con estudios de inmunohistoquímica, aunque se desconoce qué es lo que conduce a la desaparición de las células mioepiteliales en el carcinoma invasor. (Figura 2) No se conoce con precisión si esta pérdida es por eliminación selectiva de células mioepiteliales por apoptosis, o si se destituyen por la sobreproducción de enzimas degradantes, o si esto resulta de una alteración de la diferen-ciación celular mioepitelial normal a partir de las células madre (stem cells). Sea cual fuere la causa, se pierde la capa protectora de las células mioepiteliales por lo que las células tumorales ductales luminales pueden invadir fácilmente el estroma y dar metástasis a otros órganos distantes.10,21
Las células mioepiteliales sí están presentes en los conductos del carcinoma in situ, pero estas no son normales. Por estudios genómicos com-parativos se han demostrado diferencias entre las células mioepiteliales del carcinoma in situ y las de los conductos de las glándulas mamarias normales.23 Se ha demostrado que en el cáncer in situ las células mioepiteliales muestran disminu-ción de la expresión de receptores de oxitocina, laminina-1 y trombospondina, pero hay mayor expresión de SDF1/CXCL12 y CXCL14, que son quimiocinas responsables de la proliferación, migración e invasión celular.6 Además, se ha confirmado el aumento de la producción de

221
Ruiz Delgadillo I y col. Estructura y características de las células mioepitelialesw w w . r e v i s t a p a t o l o g i a . c o m
Patología Revista Latinoamericana
metaloproteinasas, que son enzimas que partici-pan en la degradación de la matriz extracelular y en varios cambios epigenéticos relacionados con la metilación del ADN (ácido desoxirribo-nucleico).23 Las células mioepiteliales asociadas del cáncer in situ van perdiendo paulatinamente el contacto con las células luminales, lo que conduce a alteraciones en la polarización de las células luminales y la inhibición de la síntesis de los componentes de la membrana basal. Los tu-mores mamarios con células mioepiteliales que sintetizan adecuadamente los componentes de la membrana basal, no dan metástasis a distancia, y tienen mejor pronóstico.24 Por lo anterior, puede
Figura 2. (A) Carcinoma ductal infiltrante (flechas) con áreas de carcinoma ductal in situ. (B) Inmunohistoquí-mica de la misma área marcada con CD10 que muestra la irregularidad de las células mioepiteliales (flechas) y la pérdida completa en la zona invasora. Las células mioepiteliales asociadas del cáncer in situ van perdiendo, paulatinamente, el contacto con las células luminales, lo que conduce a alteraciones en la polarización de las células luminales y la inhibición de la síntesis de los componentes de la membrana basal.
afirmarse que las células mioepiteliales son las responsables de inhibir las alteraciones asocia-das con transformación maligna de las células ductales luminales.18,19,21 Cuando se aíslan célu-las mioepiteliales de tumores mamarios benignos (mioepitelioma), éstas se caracterizan por poseer alta expresión de inhibidores de la angiogénesis como TIMP-1, trombospondina o maspina, y un bajo nivel de factores pro-angiogénicos.18
La inmunohistoquímica para la identificación de células mioepiteliales es de gran ayuda en el momento de diferenciar lesiones benignas de malignas en la glándula mamaria, pues el carci-

222
Patología Revista latinoamericana Volumen 56, Núm. 3, julio-septiembre, 2018
noma ductal carece de células mioepiteliales y las proliferaciones benignas característicamente están rodeadas de células mioepiteliales (Figura 3). La única excepción a lo anterior es la ade-nosis microglandular, que es una proliferación benigna poco frecuente que carece de células mioepiteliales.25 En el Cuadro 1 se resumen los marcadores diagnósticos utilizados con más frecuencia para identificar células mioepiteliales en la glándula mamaria.
Puesto que la glándula mamaria cuenta con diferentes tipos celulares, cada uno de estos expresa distintas proteínas que se son de utili-dad al momento de establecer el diagnóstico de lesiones mamarias.15,16,26 (Figura 4) Las células luminales expresan diversas citoqueratinas (CK 7, 8, 18, 19), antígeno membranal epitelial (EMA), antígeno de membrana de la grasa de
leche (GCDFP-15, por sus siglas en inglés Gross cystic disease fluid protein 15), α-lactoalbúmina y receptores para estrógeno y progesterona. Las células mioepiteliales, como fue expuesto en párrafos anteriores, son positivas a diversas citoqueratinas como 34βE12 (que reconoce CK1,5,10,14), CK5/6, CK14, y CK17 y algunos otros marcadores como actina del músculo liso (α-SMA por sus siglas en inglés smooth muscle actin- alpha), h-caldesmon, calponina, p63, laminina-1 y cadena pesada de miosina del músculo liso (SMMHC por sus siglas en inglés , Smooth muscle myosin heavy chain), CD10 (CALLA, por sus siglas en inglés: common acute lymphoblastic leukemia antigen), P-cadherina y proteína S-100 (Tabla 1) (Figura 5). Hay que tener en cuenta que algunos de estos marcadores no son totalmente específicos para identificar células mioepiteliales. Por ejemplo, la proteína S-100 al igual que el CD10 puede reconocer otros tipos celulares que incluyen a las células luminales de los conductos mamarios y las células ductales tumorales mamarias.15,16 De la misma manera la CK14 y CK17 además de ser positivas en las células mioepiteliales, marcan las células acinares lo que puede impedir la adecua-da identificación de las células mioepiteliales. La actina de músculo liso se expresa también en los miofibroblastos y la pared de los vasos sanguíneos, lo que puede dificultar el reconoci-miento adecuado de las células mioepiteliales, en particular en los carcinomas con desmoplasia estromal, o si se encuentra algún vaso sanguíneo próximo a la lesión, lo que puede derivar en una malinterpretación y generar un diagnóstico erróneo.15,27 Lo mismo sucede con la calponina, que es una proteína fijadora de calcio del aparato contráctil en células de músculo liso y células mioepiteliales, que tiene la misma sensibilidad que la actina de músculo liso, por lo que marca miofibroblastos y el músculo liso de los vasos sanguíneos.15,16,28
La proteína p63 es un factor de transcripción, miembro de la familia p53 de supresores de
Cuadro 1. Marcadores diagnósticos utilizados con más frecuencia para identificar células mioepiteliales en la glándula mamaria
Marcador Reactividad
Actina de músculo liso-alfa Citoplásmica
Actina músculo específica (HHF35)
Citoplásmica
Calponina Citoplásmica
p63 Nuclear
Cadena pesada de miosina del músculo liso (SMMHC).
Citoplásmica
CD10 Membrana y citoplásmica
S-100 Citoplásmica
Maspina (Mammary serine protease inhibitor)
Nuclear y citoplásmica
Receptor del factor de crecimiento nervioso p75 NGF
Citoplásmica
Citoqueratinas CAM5.2, CK14 y CK17
Citoplásmica
Proteína fibrilar ácida glial (GFAP) Citoplásmica
h-Caldesmon Citoplásmica
P-Cadherina Citoplásmica
D2-40 (podoplanina) Citoplásmica

223
Ruiz Delgadillo I y col. Estructura y características de las células mioepitelialesw w w . r e v i s t a p a t o l o g i a . c o m
Patología Revista Latinoamericana
Figura 3. La inmunohistoquímica es de gran ayuda para identificar células mioepiteliales en el momento de diferenciar lesiones benignas de malignas en la glándula mamaria; en las proliferaciones benignas están carac-terísticamente rodeadas de estas. La figura ilustra una adenosis esclerosante (A), que es una lesión benigna que puede simular carcinoma invasor. Una de sus características es su capa de células mioepiteliales que, en este caso, resultaron positivas a CD10 (B) y a actina (C).
tumores, cuyo gen se localiza en el cromoso-ma 3q27-29, y es positiva en los núcleos de las células mioepiteliales, células basales de la próstata y en tumores con diferenciación mioepitelial, como el carcinoma metaplásico de la mama o diversos tumores de las glándulas salivales (Figura 5). También es un marcador de diferenciación escamosa.28 La ventaja de la p63 es que se expresa exclusivamente en el núcleo de células mioepiteliales y no tiene reacciones cruzadas con otras células del tejido mamario, por lo que posee alta especificidad (casi 100%)
y 90% de sensibilidad.15,16,29 Y a pesar de que la p63 sirve para identificar células mioepiteliales normales, hay que tener presente que incluso 10% de casos de carcinoma mamario pueden tener positividad nuclear con la p63.16,28 Se ha sugerido que para la mejor identificación de las células mioepiteliales es preferible utilizar un coctel para doble inmunomarcación empleando un marcador nuclear (p63) y otro citoplasmático miosina de cadena pesada 11 de músculo liso (SMMHC).30

224
Patología Revista latinoamericana Volumen 56, Núm. 3, julio-septiembre, 2018
Mediante la inmunomarcación con la proteína ácida fibrilar glial (GFAP por sus siglas en in-glés: glial fibrillary acidic protein) se ha podido reconocer una subpoblación menor de células mioepiteliales en la glándula mamaria normal que también expresa los otros marcadores de células mioepiteliales descritos (Figura 5). El nú-mero de células mioepiteliales inmunorreactivas a la GFAP está aumentado en diversas lesiones benignas mamarias: adenomioepitelioma, fibro-adenoma, tumor filodes y ginecomastia. En las células del carcinoma mamario no se ha descrito la inmunorreactividad de GFAP.31
La miosina de cadena pesada 11 de músculo liso (SMMHC / Myosin, heavy chain 11, smooth
muscle, in humans), también conocida como miosina-11, es igualmente positiva en las células mioepiteliales. Esta proteína tiene una longitud de 1972 aminoácidos y peso molecular de 227.3 kDa, y se asocia con elementos contráctiles de diversas células. Al igual que algunos de los otros marcadores mencionados, es positiva en las células del músculo liso de la pared de los vasos sanguíneos. Pese a lo anterior existe una ventaja sobre la AML y la calponina, pues es menos re-activa con los miofibroblastos y posee mejores resultados en especificidad y sensibilidad.15,16,27
Hace poco se utilizó la maspina (mammary seri-ne protease inhibitor, SerpinB5) como marcador de células mioepiteliales pero es de utilidad
Figura 4. Diferencia inmunohistoquímica entre células luminales y células mioepiteliales. En esta inmunomar-cación las células luminales son positivas a las citoqueratinas CK 7, 8, 18, 19 (A), y las células mioepiteliales expresan proteína S-100 (B).

225
Ruiz Delgadillo I y col. Estructura y características de las células mioepitelialesw w w . r e v i s t a p a t o l o g i a . c o m
Patología Revista Latinoamericana
Figura 5. Las células mioepiteliales expresan varios antígenos. En esta figura se muestra colágena IV, h-caldesmon, proteína fibrilar ácida glial (GFAP), p63 y actina (HHF35).
limitada porque puede ser positiva también en células tumorales.16,28,32 La mapsina es una proteína codificada por el gen supresor tumoral SERPINB5, miembro de la familia de serine-proteasas, que funciona inhibiendo la capacidad de las células cancerosas para invadir y producir metástasis a otros tejidos. La producción de maspina por las células mioepiteliales es uno de los factores más importantes para la supre-sión de tumores porque actúa como inhibidor de la angiogénesis y de la movilidad celular. Puesto que las células mioepiteliales secretan grandes cantidades de mapsina se sugiere que tiene una función supresora de tumores en las
células normales, pero esta función se pierde en las células tumorales.32,33 La relaxina secretada, también por las células mioepiteliales, estimula la producción de óxido nítrico, que tiene una actividad antitumoral mediante la inhibición de la proliferación de células tumorales y, de igual forma, promueve la diferenciación celular. Au-nado a esto, una nueva proteína conocida como inhibidora de la proteinasa en suero derivada del mioepitelio (MEPI/myoepithelium-derived serine proteinase inhibitor), fue identificada exclusiva-mente en células mioepiteliales confiriéndoles la propiedad de bloquear el crecimiento de células neoplásicas de la glándula mamaria, disminuir

226
Patología Revista latinoamericana Volumen 56, Núm. 3, julio-septiembre, 2018
su potencial invasor y prevenir la diseminación tumoral in vivo.10
Por medio del análisis inmunohistoquímico y molecular de tejido mamario normal compa-rado con el del carcinoma in situ e invasor se han podido identificar varios genes que difieren en su expresión entre las células mioepiteliales normales y las del carcinoma in situ. Por ejemplo, muchos de los genes específicos de las células mioepiteliales, como CTK14, CTK17, OXTR, EGFR, están ausentes o regulados a la baja en el carcinoma in situ, lo que sugiere que estas son anormales y quizá hayan perdido algunas de sus funciones normales. En las células mioepiteliales del carcinoma in situ se ha informado mayor ex-presión de lisl oxidasa y de neuopilina-1 (NRP1) que en las células mioepiteliales normales; sin embargo, se requieren muchos más estudios para poder precisar las diferencias exactas y los me-canismos específicos de progresión al carcinoma invasor, entre las células mioepiteliales normales y las del carcinoma in situ.21
En el 2011, Pandey y su grupo propusieron dos hipótesis para explicar la pérdida de las células mioepiteliales y el mecanismo de progresión del carcinoma in situ al invasor.10 De acuerdo con la primera, la invasión celular tumoral se desencadena por la sobreproducción de enzimas proteolíticas, como las matrixinas-metalopro-teinasas de matriz (MMPs), serina-proteasas y catepsinas por las células mioepiteliales y células tumorales circundantes, lo que da por resultado la degradación de la membrana basal y facilita la migración celular. La segunda hipótesis esta-blece que la invasión tumoral es un proceso de pasos múltiples donde las interacciones entre las células mioepiteliales alteradas y las células inmunes (linfocitos y macrófagos), desencade-nan la liberación de enzimas degradantes de la membrana basal que causan la progresión tumoral. En esta segunda hipótesis, durante la interrupción de la capa de células mioepitelia-
les ocurren una serie de eventos que alteran el microambiente y facilitan la invasión tumoral. La invasión tumoral comienza con el daño de las células mioepiteliales por alguna alteración genética, inflamación o cualquier lesión física o química que derive en la interrupción de la capa celular. Esto implica la pérdida de algunas propiedades, como la secreción de maspina y otros factores inhibidores que alteran el mi-croambiente tumoral. Además, la infiltración de leucocitos y macrófagos a la zona de la lesión resulta en la liberación de enzimas digestivas y degradantes de matriz que destruyen las célu-las mioepiteliales. De igual forma, las células mioepiteliales dañadas liberan diversas proteasas que degradan la membrana basal y generan una brecha por la que pueden ingresar las células tumorales al estroma y proliferar, y convertirse en carcinoma invasor.10,26 Otro factor que se ha estudiado y que juega un papel importante en la progresión del cáncer de mama es el pH ácido extracelular que, aunque no se menciona en ninguna de las hipótesis anteriores, se ha visto que promueve el potencial metastásico de las células tumorales, aunque la razón de esto permanece desconocida.10
CONCLUSIÓN
En la glándula mamaria sana las células mioepi-teliales son las encargadas de la contracción glandular para la expulsión de leche en respuesta a la oxitocina. Sin embargo, estas tienen, ade-más, otras funciones fisiológicas importantes: regulación del crecimiento, diferenciación celular y morfogénesis de células vecinas lu-minales ductales y mioepiteliales adyacentes que secretan diversos factores de crecimiento y citosinas.7 Igualmente, por la liberación de estas moléculas, las células mioepiteliales tienen la posibilidad de alterar el microambiente tisular. Las células mioepiteliales producen un efecto inhibidor (supresión tumoral) del crecimiento, la invasión y la angiogénesis de las células del carcinoma mamario.

227
Ruiz Delgadillo I y col. Estructura y características de las células mioepitelialesw w w . r e v i s t a p a t o l o g i a . c o m
Patología Revista Latinoamericana
En virtud de la importancia de las células mioepi-teliales es necesario conocer los marcadores inmunohistoquímicos para poder identificarlas (Cuadro 1). Hay que recordar que lo ideal es utilizar doble marcación (citoplasmática y nuclear-con actina y p63, respectivamente) para evitar un falso negativo, por la posible marcación de miofibroblastos y células de músculo liso de los vasos cercanos a la lesión.
Es evidente que las células mioepiteliales juegan un papel transcendental en el proceso de inva-sión tumoral debido a la secreción de diversas moléculas que pueden degradar la membrana basal, la hipoxia y la inflamación.34 Estos datos apoyan la hipótesis de que la función supresora tumoral de las células mioepiteliales se pierde con la progresión del carcinoma in situ, lo que resulta en la transición del cáncer preinvasor al invasor.34
Aún permanecen varias preguntas por resolver como: ¿cuáles son los mecanismos puntuales de la degradación de la capa de célula mioepite-liales? ¿Cuál es la causa de la sobreproducción de las enzimas degradantes y otras moléculas? ¿Podría ser que las células tumorales sean las que conduzcan a las células mioepiteliales a producir las enzimas de degradación, o son las propias células tumorales las que producen tales molé-culas y enzimas? Queda mucho por aprender acerca del papel fisiológico y los mecanismos moleculares de las células mioepiteliales en el proceso de invasión tumoral y metástasis. Este conocimiento puede conducir al desarrollo de nuevos enfoques para la prevención y tratamien-to con blancos moleculares en el carcinoma de la glándula mamaria.35
REFERENCIAS
1. El cáncer de mama en las américas. Recuperado el 20 de septiembre de 2018 de: https://www.paho.org/hq/dmdocuments/2014/OPS-Nota-Informativa-Cancer-Mama-2014.pdf
2. INEGI. “Estadísticas a propósito del día mundial contra el cáncer (4 de febrero)”. México; 2018. Recuperado el 8 de mayo de 2018 de http://www.beta.inegi.org.mx/conteni-dos/saladeprensa/aproposito/2018/cancer2018_Nal.pdf
3. Guinebretière JM, Menet E, Tardivon A, Cherel P, Vanel D. Normal and pathological breast, the histological basis. Eur J Radiol. 2005;54:6-14.
4. Singal R, Singal RP, Mittal A, Sangwan S, Gupta N. Sir Astley Paston Cooper. History, English Surgeon and Anatomist. Indian J Surg. 2011;73:82-84.
5. Cristea S, Polyak K. Dissecting the mammary gland one cell at a time. Nat Commun. 2018;9:2473
6. Sopel M. The myoepithelial cell: its role in normal mamma-ry glands and breast cancer. Folia Morphol. 2010;69:1-14
7. Moumen M, Chiche A, Cagnet S, Petit V, Raymond K. Far-aldo MM, Deugnier M-A, Glukhova MA. The mammary myoepithelial cell. Int J Dev Biol. 2011:55:763-771
8. Villadsen R, Fridriksdottir AJ, Ronnov-Jessen L, Gudjonsson T, Rank F, LaBarge MA, Bissell MJ, Petersen OW. Evidence for a stem cell hierarchy in the adult human breast. J Cell Biol. 2007177: 87-101.
9. Deugnier MA, Teulière J, Faraldo MM, Thiery JP, Glukhova MA. The importance of being a myoepithelial cell. Breast Cancer Res 2002;4:224-230
10. Pandey P., Saidou J, Watabe K. Role of myoepithelial cells in breast tumor progression. Front Biosci. 2011; 15: 226-236
11. Gudjonsson T., Adriance M., Sternlicht M., Petersen O., Bissell M. Myoepithelial Cells: Their Origin and Function in Breast Morphogenesis and Neoplasia. J Mammary Gland Biol Neoplasia. 2005;10:261-272.
12. Dewar R1, Fadare O, Gilmore H, Gown AM. Best practices in diagnostic immunohistochemistry: myoepithelial markers in breast pathology. Arch Pathol Lab Med. 2011;135:422-429.
13. Nowak A, Dziegiel P. Implications of nestin in breast cancer pathogenesis (Review). Int J Oncol. 2018;53:477-487.
14. Rabban JT1, Chen YY. D2-40 expression by breast my-oepithelium: potential pitfalls in distinguishing intralym-phatic carcinoma from in situ carcinoma. Hum Pathol. 2008;39:175-183.
15. Collins LA, Schnitt SJ. Breast in: Miles S.E. Ed. Histology for Pathologists 4th Ed. Wolter Kluwer Philadelphia, 2012; pp 70-72
16. Liu H, Application of Immunohistochemistry in Breast Pathology. A Review and Update. Arch Pathol Lab Med. 2014;138:1629-1642
17. Reis-Filho JS, Milanezi F, Amendoeira I, Albergaria A, Schmitt FC. p63 staining of myoepithelial cells in breast fine needle aspirates: a study of its role in differentiating in situ from invasive ductal carcinomas of the breast. Clin Pathol 2002;55:936-939
18. Barsky SH, Karlin NJ. Myoepithelial Cells: Autocrine and Paracrine Suppressors of Breast Cancer Progression. J Mammary Gland Biol Neoplasia. 200510:249-260.

228
Patología Revista latinoamericana Volumen 56, Núm. 3, julio-septiembre, 2018
19. Sirka OK, Shamir ER, Ewald AJ. Myoepithelial cells are a dynamic barrier to epithelial dissemination. J Cell Biol. 2018; [Epub ahead of print]
20. Zhang RR, Man YG, Vang R, Saenger JS, Barner R, Wheeler DT, Liang CY, Vinh TN, Bratthauer GL. A subset of mor-phologically distinct mammary myoepithelial cells lacks corresponding immunophenotypic markers. Breast Cancer Res 2003;5:R151-6.
21. Polyak K., Hu M. Do Myoepithelial Cells Hold the Key for Breast Tumor Progression?. J Mammary Gland Biol Neo-plasia. 2005;10:231-247.
22. Shao ZM, Radziszewski WJ, Barsky SH. Tamoxifen enhances myoepithelial cell suppression of human breast carcinoma progression in vitro by two different effector mechanisms. Cancer Lett 2000;157:133-44
23. Allinen M, Beroukhim R, Cai L, Brennan C, Lahti-Domenici J, Huang H, Porter D, Hu M, Chin L, Richardson A, Schnitt S, Sellers WR, Polyak K. Molecular characterization of the tumor microenvironment in breast cancer. Cancer Cell, 2004;6:17-32.
24. Kasami M, Olson SJ, Simpson JF, Page DL. Maintenance of polarity and a dual cell population in adenoid cystic carcinoma of the breast: an immunohistochemical study. Histopathology, 1998;32: 232–238.
25. Foschini MP, Eusebi V. Microglandular adenosis of the breast: a deceptive and still mysterious benign lesion. Hum Pathol. 2018: S0046-8177(18)30239-9. [Epub ahead of print]
26. Faraldo MM, TeulieJ, Deugnier M-A, La Hosseraye IT-D, Thiery JP,Glukhova MA. Myoepithelial Cells in the Control of Mammary Development and Tumorigenesis: Data from Genetically Modified Mice. J Mammary Gland Biol Neopla-sia. 2005;10:211-219.
27. Zaha D. Significance of immunohistochemistry in breast cancer. World J Clin Oncol 2014;5: 382-392.
28. Bhargava R, Dabbs DJ. Immunohistochemistry of the breast. En: Diagnostic immunohistochemistry: theranostic and genomic applications. Chapter 19 4th Ed Philadelphia: Saunders/Elsevier; 2010 pp 710-716.
29. Liu QY, Niranjan B, Gomes P, Gomm JJ, Davies D, Coombes RC, Buluwela L. Inhibitory effects of activin on the growth and morphogenesis of primary and transformed mammary epithelial cells. Cancer Res,1996;56:1155-1163.
30. Ichihara S, Fujimoto T, Hashimoto K, Moritani S, Hasegawa M, Yokoi T. Double immunostaining with p63 and high-molecular-weight cytokeratins distinguishes borderline papillary lesions of the breast. Pathol Int. 2007;57:126-132.
31. Viale G, Gambacorta M, Coggi G, Dell’Orto P, Milani M, Doglioni C Glial fibrillary acidic protein immunoreactivity in normal and diseased human breast. Virchows Arch A Pathol Anat Histopathol. 1991;418:339-348.
32. Dabiri S, Moeini Aghtaei M, Shahryari J, Shamis Meymandi M, Amirpour-Rostami S, Foutohi Ardekani R. Maspin Gene Expression in Invasive Ductal Carcinoma of Breast. Iran J Pathol. 2016;11:104-111.
33. Bernardo MM, Dzinic SH, Matta MJ,Dean I, Saker L, Sheng S. The Opportunity of Precision Medicine for Breast Cancer with Context-Sensitive Tumor Suppressor Maspin. J Cell Biochem. 2017;118:1639-1647
34. Russell TD, Jindal S, Agunbiade S, Gao D, Troxell M, Borges FV, Schedin P. Myoepithelial Cell Differentiation Mark-ers in Ductal Carcinoma in Situ Progression. Am J Path 2015;185:3076-3089
35. Goodwin K, Nelson CM. Myoepithelial crowd control of cancer cells. J Cell Biol 2018:7:1-3