PROCEDIMIENTOS AN ALÍTICOS EN EL ESTUDIO DE LOS ISÓTOPOS (Isótopos pesados)
Teoría atómica. Z, A, isótopos, n, p, e-. Iones. Masa ... · los electrones en el átomo. Se...
Transcript of Teoría atómica. Z, A, isótopos, n, p, e-. Iones. Masa ... · los electrones en el átomo. Se...

Página 1 de 14
Teoría atómica. Z, A, isótopos, n, p, e-. Iones. Masa atómica. Definiciones
Teorías atómicas
Seguidamente se expone un pequeño resumen de las teorías atómicas que te serán de utilidad en este
curso, para más información acude a tu libro de texto o apuntes.
Teoría atómica de Dalton
Se puede resumir en estos puntos:
- Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas
átomos.
- Todos los átomos de un elemento químico son iguales.
- Los átomos de diferentes elementos químicos son diferentes.
- Los átomos son indestructibles y retienen su identidad en los cambios químicos.
- Los compuestos se forman cuando átomos de diferentes elementos se combinan entre sí,
formando “átomos compuestos” (hoy llamadas moléculas).
Aunque con errores como el no tener en cuenta la existencia de isótopos o la falta de explicación de la
estructura interna del propio átomo, este modelo se puede considerar como uno de los pilares de la
química.
Modelo atómico de Thomson
Supuso que el átomo era una especie de pudín formado por una masa positiva en la que se encontraban
insertados los electrones (partículas que Thomson identifico). Ciertamente no tuvo en cuenta la existencia
de protones ni de neutrones que fueron descubiertos posteriormente.
Modelo de Rutherford
Su modelo se basa en un experimento que podrás ver en el libro. Su modelo nos muestra un átomo
prácticamente vacío en el que casi toda la masa se concentra en una región muy pequeña llamada núcleo.
El núcleo contiene toda la carga positiva. Por tanto, el núcleo contendría los protones (carga positiva) y
neutrones (descubiertos más adelante por Chadwick). El resto del átomo contiene la carga negativa pero
su masa es despreciable (los electrones tienen una masa unas 1840 veces inferior a la del neutrón o la del
protón).
Para hacerse una idea sería como si se encontrase una mosca en una catedral. La catedral sería el átomo y
la mosca su núcleo.
Modelo atómico de Bohr
Lo que te interesa de este modelo es que realiza una explicación bastante acertada de cómo se encuentran
los electrones en el átomo. Se basa en el modelo de Rutherford (núcleo y corteza) y explica que los
electrones deben estar girando en determinadas órbitas alrededor del núcleo y sólo en esas órbitas. Las
órbitas que él supuso eran circulares, aunque posteriores variaciones del modelo atómico introdujeron las
órbitas elípticas.
Estructura del átomo
El átomo está compuesto de las siguientes partes:
• Un núcleo muy pequeño en el que se encuentra casi toda la masa y en el que se encuentra la carga
positiva del átomo.
• La corteza o resto del átomo que rodea el núcleo, tiene una masa despreciable desde un punto de
vista químico y contiene toda la carga negativa del átomo.
Las partículas más estables del átomo y que nos interesan en química son:
Partículas Masa Carga
Real Relativa Real Relativa
Protón 1,6726·10-27 kg 1 + 1,602·10-19 C +1
Neutrón 1,675·10-27 kg 1 0 0
Electrón 9,109·10-31 kg 0 - 1,602·10-19 C -1
Número atómico
Número atómico es el número de protones que contiene el núcleo, se representa con la letra Z. El número
atómico sirve para diferenciar unos elementos de otros:

Página 2 de 14
Dos elementos iguales siempre tienen el mismo número de protones (mismo número atómico). Ejemplo:
Cualquier átomo de hidrógeno siempre tendrá un protón.
Dos elementos diferentes nunca tienen el mismo número de protones (distinto número atómico). Ejemplo:
La diferencia entre el hidrógeno y el helio, es que el hidrógeno (Z=1) tiene un protón y el helio (Z=2)
tiene dos protones.
Si el átomo es neutro (mismo número de cargas positivas y negativas), el número atómico coincide con el
número de electrones, sólo en este caso.
Número másico
Número másico es el número de nucleones del núcleo atómico; es decir, el número total de protones (p)
más neutrones (n) del átomo (p+n). Se representa con la letra A.
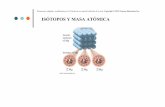
Isótopos
Los isótopos son átomos de un mismo elemento (una misma Z) que tienen diferente número másico (A).
Es decir, átomos que tienen el mismo número de protones (Z) pero diferente número de neutrones (A=p +
n cambia).
Ejemplo de isótopos.
Tengamos el átomo y el átomo . Ambos son del mismo elemento (Boro) dado que los dos tienen
de número atómico 5 (número de protones del núcleo), se diferencian en el número másico. Uno de ellos
tiene 11 de número másico y el otro 10. Ambos átomos del mismo elemento que se diferencian en el
número másico se denominan isótopos de dicho elemento. Como el número másico es la suma de
protones y neutrones, tendremos:
: A = p + n ; 11 = 5 + n ; n = 11 - 5 = 6 neutrones
: A = p + n ; 10 = 5 + n ; n = 10 - 5 = 5 neutrones
Por tanto, los isótopos del mismo elemento se diferencian en el número de neutrones.
Por último, existe un gran número de isótopos que no son estables. Se desintegrarán por procesos de
decaimiento radiactivo. Los isótopos que son radiactivos se llaman radioisótopos.
Iones
Son átomos cargados (positivos o negativos). Como el núcleo es intocable con las energías que aparecen
en las reacciones químicas, la única forma de que un átomo se cargue eléctricamente es quitando o
poniendo electrones:
• Iones positivos, también llamados cationes, son átomos que han perdido electrones. Cada electrón
que pierden es una carga positiva que queda en exceso en el núcleo.
• Iones negativos, también llamados aniones, son átomos que han ganado electrones. Cada electrón
que ganan es una carga negativa en exceso sobre los protones del núcleo.
Los átomos neutros tienen tantos protones (carga positiva) como electrones (carga negativa). Como
ambas partículas tienen la misma carga pero con distinto signo, al tener la misma cantidad de ambas el
átomo es neutro. Cuando quitamos electrones quedan más cargas positivas que negativas. Cuando
añadimos electrones tenemos más cargas negativas que positivas.
Representación
Se utiliza el siguiente sistema de símbolos para representar un átomo o conjunto de átomos:
Donde X será el símbolo del elemento. Z es el número atómico y A el número másico. Como
comprenderás no siempre se colocan todos estos símbolos rodeando al elemento, se ponen aquellos que
interesan.
Ejemplos:
1. La información que podemos extraer de esta representación es la siguiente:
- Se trataría del Selenio (Se)
- Tiene de número atómico 34 (Z=34, 34 protones)
- Tiene de número másico 78: A=78, A-Z= n, 78-34=44 neutrones.

Página 3 de 14
- El número de electrones es igual al de protones dado que el átomo es neutro (no pone
nada en la esquina superior derecha); por tanto al ser Z=34 tiene 34 protones y tendrá el
átomo neutro 34 electrones (e-).
2. La información que podemos extraer de esta representación es la siguiente:
- Se trataría del Selenio (Se)
- Tiene de número atómico 34 (Z=34, 34 protones)
- Tiene de número másico 78: A=78, A-Z= n, 78-34=44 neutrones.
- El número de electrones no puede ser 34 dado que el átomo está cargado negativamente
(ion negativo o anión). El número de electrones es 34 + 2 = 36 e- : 34 electrones (que
equilibran a los 34 protones) más dos cargas negativas que tiene, véase esquina superior
derecha.
Masa atómica
Se llama masa atómica de un elemento a la masa de uno de sus átomos medida en unidades de masa
atómica, se representa con los símbolos ‘u’ o ‘uma’. La unidad de masa atómica equivale a 1,66·10-27kg;
es decir, 0,00000000000000000000000000166 kg. Equivale a la doceava parte de la masa del isótopo de
carbono 12.
Si un elemento tiene varios isótopos, el valor que se toma como masa atómica es el promedio de las
masas de los isótopos según su abundancia en la naturaleza.
Configuración electrónica. Números cuánticos. Definiciones Configuración electrónica
Como sabes en la corteza atómica se encuentran los electrones moviéndose alrededor del núcleo atómico.
Los electrones se encuentran en la corteza en diferentes capas o niveles. En cada capa o nivel se
puede situar un número máximo de electrones que viene dado por la expresión: nº electrones = 2·n2,
donde n es el número de orden de la capa o nivel.
A su vez, los electrones se encuentran en cada nivel distribuidos en diferentes subniveles
denominados con las letras s, p d, f, etc. El número de electrones que cabe en cada subnivel es el
siguiente:
Subnivel
Número de
electrones que
puede haber
como máximo
s 2
p 6
d 10
f 14
El tipo de subnivel que puede tener un nivel dado depende del número de electrones máximo del mismo:
Nivel (n)
Número máximo de
electrones que se pueden
poner (2·n2)
Subniveles que tiene
1 2·12 = 2·1 = 2 S
2 2·22=2·4=8 s, p
3
2·32=2·9=18 s, p, d
4 2·42=2·16=32 s, p, d, f
Para tener una idea muy aproximada de la distribución de los electrones en los diferentes niveles y
subniveles se utiliza el diagrama de Möller. Este diagrama indica el orden de llenado de los subniveles y

Página 4 de 14
niveles de energía de un átomo, de arriba hacia abajo, siguiendo el sentido de las flechas, hasta llegar al
número de electrones que tiene dicho átomo.
Ejemplo. Escribe la estructura electrónica (distribución de electrones en la corteza) del elemento Ho (Z
= 67).
El número de protones coincide con el número atómico, es decir tendrá 67 protones. En el átomo
neutro habrá tantos protones como electrones: nº e- = 67. Dibujando el diagrama de Möller, se van
cubriendo los huecos hasta alcanzar el número de 67 electrones.
La configuración electrónica es:
1 s2 2 s2 p6 3 s2 p6 d10 4 s2 p6 d10 5 s2 p6 6 s2 4 f11
El subnivel que se está llenando se debe poner al final, en nuestro ejemplo 4 f11.
En química resulta de importancia los electrones más lejanos al núcleo:
- Electrones de los subniveles ‘s’ y / o ‘p’ del último subnivel.

Página 5 de 14
- Electrones de los subniveles ‘d’ o ‘f’ que estén incompletos.
En nuestro ejemplo los electrones que resultan de interés en química serían 6 s2 4 f11 al ser lo que están
más lejos del núcleo, resultando más fácil que intervengan en las reacciones químicas habituales.
El resto de los electrones se encuentran en niveles / subniveles más unidos al núcleo, resultando más
difícil extraerlos / moverlos a otros niveles en las reacciones químicas habituales.
Números cuánticos
Como hemos dicho anteriormente, los electrones sólo pueden estar en determinadas órbitas alrededor del
núcleo atómico, el resto de las posiciones está restringido al electrón. Cada una de dichas restricciones
viene dada por un concepto que denominamos número cuántico. En tercero de la ESO sólo vemos dos
restricciones de las cuatro que hay:
- La distancia al núcleo nos da el nivel de energía en el que se encuentra el electrón (lo que hemos
denominado n), se denomina número cuántico principal.
La forma de la órbita es otro tipo de restricción (lo que hemos denominado subnivel de energía que viene
dado por las letras, s, p, d, f, …), se denomina número cuántico secundario.
Propiedades de los períodos y de los grupos. Electronegatividad
Introducción
Las propiedades químicas de los elementos tienen una relación muy estrecha con la colocación de los
mismos en la tabla periódica:
• Las propiedades son muy similares para los elementos del mismo grupo.
• Las propiedades varían a lo largo del período para volverse a repetir en el siguiente período.
La relación entre la variación de las propiedades y la situación en la tabla periódica está relacionada con
la configuración electrónica de los elementos.
Para que puedas comprender a que nos referimos debes realizar la actividad titulada "Periodicidad y
configuración electrónica". Cuando la hayas realizado podrás comprender que lo importante de la
configuración electrónica son los denominados electrones de valencia.
Los electrones de valencia son los de la última capa (electrones 's' y 'p'); también son de interés químico
los electrones de los subniveles 'd' / 'f' que se encuentran incompletos.
Las propiedades están en relación con la capacidad de perder, ganar o compartir electrones los átomos
para que su configuración electrónica se parezca a la del gas noble más cercano.
Tamaño del átomo
La medida del tamaño del átomo se lleva a cabo mediante la determinación de su radio.
El tamaño depende de dos factores:
- La atracción entre la carga positiva del núcleo y la negativa de la corteza.
• A menor distancia mayor será la fuerza.
• Para la misma distancia, si aumentan las cargas, mayor será la fuerza de atracción.
- La repulsión entre las cargas negativas de los electrones y el aumento del número de capas.
• Al aumentar el número de capas en un grupo, el aumento del número de protones del
núcleo y de electrones de la corteza (aumento de la fuerza de atracción entre cargas
opuestas), no compensa el aumento de la distancia. Por tanto, el aumento del número de
capas disminuye la fuerza de atracción de los electrones más externos. Por otro lado, las
últimas capas estarán más lejos del núcleo.
• En un período la distancia entre los electrones más externos y el núcleo se mantiene en
términos globales. Cada protón que introducimos en el núcleo al pasar a otro elemento del
mismo período, aumenta la fuerza de atracción. Por otro lado, cada electrón que
introducimos al pasar a otro elemento del mismo período, aumenta la fuerza de repulsión
entre electrones. Salvo pequeñas variaciones, en un período es mayor la fuerza de
atracción que de repulsión.
En resumen, el radio atómico varía de la siguiente forma:

Página 6 de 14
• En un grupo el tamaño aumenta a medida que bajamos en el mismo (mayor número atómico).
Cuanto más abajo más lejos se encontrarán los electrones, la última capa estará más lejos del
núcleo. Mayor distancia entre cargas positivas y negativas significa menor fuerza de atracción y,
por tanto, mayor tamaño.
• En un período disminuye por lo general el tamaño a medida que avanzamos en el mismo (mayor
número atómico). Los electrones nuevos de cada elemento se ponen en la misma capa, a la misma
distancia del núcleo. La fuerza de atracción entre el núcleo (mayor número de cargas positivas a
medida que avanzamos en el período) y la capa de electrones aumenta dado que la distancia es la
misma pero las cargas son mayores. Mayor fuerza de atracción implica menor tamaño, se acerca la
capa de electrones al núcleo.
Electronegatividad
La electronegatividad mide la tendencia de un átomo para atraer la nube electrónica hacia sí durante el
enlace con otro átomo. La escala de Pauling es un método ampliamente usado para ordenar los elementos
químicos de acuerdo con su electronegatividad, desarrolló esta escala en 1932.
Los valores de electronegatividad no están calculados, ni basados en fórmulas matemáticas ni medidas.
Pauling le dio un valor de 4,0 al elemento con la electronegatividad más alta posible, el flúor. Al francio,
el elemento con la electronegatividad más baja posible, se le dio un valor de 0,7. A todos los elementos
restantes se les dio un valor entre estos dos extremos.
• En un grupo la tendencia a perder electrones aumenta a medida que bajamos en el grupo. Los
electrones estarán más lejos del núcleo cuanto más abajo nos encontremos en el grupo, resultará
más fácil que los pierda y más difícil que los gane. La electronegatividad disminuye al bajar en el
grupo.
• En un período la tendencia a perder electrones disminuye a medida que avanzamos en el período,
los electrones se encuentran más unidos al núcleo (ver lo que se explicaba para el tamaño). Por
tanto, a medida que avanzamos aumentará la tendencia coger electrones más que a perderlos,
aumentará la electronegatividad.

Página 7 de 14
Reactividad de metales y no metales (ver regla del octeto)
Como dijimos anteriormente los elementos tienen tendencia a parecerse a los gases nobles más cercanos
en cuanto a su configuración electrónica de la última capa. Los menos electronegativos tendrán tendencia
a perder electrones frente a otros más electronegativos.
La reactividad de un elemento mide la tendencia a combinarse con otros.
• Variación de la reactividad en los períodos. Son más reactivos los grupos de la izquierda que los
de la derecha dado que resulta más fácil perder un electrón de la última capa que dos, tres, ...
Cuando llegamos a cierto grupo la tendencia se invierte dado que resultará más fácil ganar los
electrones que le faltan para parecerse al gas noble más cercano. Por tanto, en un período
o La reactividad de los metales aumenta cuanto más a la izquierda en el período (menos
electrones a quitar).
o La reactividad de los no metales aumenta al avanzar en el período (menos electrones a
coger).
• Variación de la reactividad en los grupos. A medida que descendemos en un grupo, los electrones
de la última capa se encuentran más lejos del núcleo y, por tanto, resultará más fácil quitárselos y,
en el caso de los no metales, más difícil el coger electrones.
o La reactividad de los metales aumenta al avanzar en un grupo (mayor tendencia a perder
electrones).
o La reactividad de los no metales aumenta cuanto más arriba en el grupo (mayor tendencia
a coger electrones)

Página 8 de 14
Regla del octeto
En la formación de compuestos existe una tendencia a coger, perder o compartir electrones entre los
átomos y de esta forma parecerse a la configuración electrónica del gas noble más cercano (ocho
electrones en la última capa salvo el helio que sólo tiene dos). Esta tendencia se denomina 'Regla del
octeto'.
La regla del octeto permite explicar que los metales adquieren la configuración de gas noble perdiendo
electrones mientras que los no metales la adquieren compartiéndolos.
Enlace. Estructura de Lewis. Tipos de enlace
Enlace químico El enlace químico es la fuerza que mantiene unidos a grupos de dos o más átomos, iguales o distintos,
formando sustancias simples poliatómicas o sustancias compuestas. También podemos definir el enlace
químico como un proceso en el que los átomos ganan, pierden o comparten electrones de las capas
externas hasta conseguir la configuración propia de un gas noble.
La forma en que los átomos se enlazan es determinante sobre las propiedades físicas y químicas de las
sustancias. Por ejemplo, al respirar monóxido de carbono, las moléculas de CO se enlazan fuertemente a
ciertas sustancias presentes en los glóbulos rojos de la sangre haciendo que estos no puedan unirse al
oxígeno.
Las reacciones químicas se basan en la rotura y creación de enlaces químicos, de aquí la importancia del
estudio del mismo. Las preguntas clave en el estudio del enlace químico son:
• ¿Qué es realmente el enlace químico o qué mantiene unidos los átomos?
• ¿Qué tipo de enlaces podemos encontrarnos?
• ¿Cómo es el mecanismo del enlace químico?
• ¿Qué factores determinan que unos enlaces sean más fuertes que otros?
La fuerza del enlace está relacionada con la energía de enlace, o sea la energía necesaria para romper el
enlace. Mayor energía de enlace indicará que el enlace es más fuerte.

Página 9 de 14
Estructura de Lewis Como se ha mencionado anteriormente, los electrones de mayor interés en química son los más externos.
Una forma de abordar el estudio de los enlaces químicos es visualizar qué les ocurre a dichos electrones
cuando se forma el enlace, esto lo podemos hacer utilizando las denominadas ‘Estructuras de Lewis’.
En la estructura de Lewis el símbolo del elemento está rodeado de puntos o pequeñas cruces que
corresponden al número de electrones presentes en la capa más externa, la también denominada capa de
valencia.
Un esquema en el que se utilizan las estructuras de Lewis sería de la siguiente forma:
1. Primero pondríamos los átomos sin enlazar, rodeado cada uno de tantos puntos o cruces como
electrones posee en la última capa.
2. Pondríamos después una flecha para indicar el proceso del enlace químico.
3. A la derecha de la flecha pondríamos los átomos enlazados, el enlace serían los átomos que ha
sido cogidos o son compartidos. No olvides:
• Considera que cada enlace se formará a partir de dos, y solo dos, electrones. Podemos
encontrarnos:
o Enlace sencillo en el que se encuentran implicados dos electrones.
o Enlace doble en el que se encuentran implicados cuatro electrones (dos por enlace).
o Enlace triple en el que se encuentran implicados seis electrones (dos por enlace)
• Cada átomo deberá cumplir con la regla del octeto o la del dueto para los casos
mencionados anteriormente.
Enlace iónico. Consideraciones básicas
¿Qué es el enlace iónico?
Es el enlace que se da entre elementos de electronegatividades muy diferentes. Se produce una cesión
de electrones del elemento menos electronegativo al mas electronegativo y se forman los respectivos
iones positivos (los que pierden electrones) y negativos (los átomos que ganan los electrones).
Este tipo de enlace suele darse entre elementos que están a un extremo y otro de la tabla periódica. O
sea, el enlace se produce entre elementos muy electronegativos (no metales) y elementos poco
electronegativos (metales).
¿Qué mantiene la unión?
La fuerza de atracción entre las cargas positivas y las cargas negativas que se forman; es decir, la
fuerza de atracción entre los cationes y los aniones.
¿Se forman moléculas?
No, se forman redes cristalinas (ordenadas). Por tanto, los iones que se forman con este enlace no
forman moléculas aisladas, sino que se agrupan de forma ordenada en redes en las que el número de
cargas positivas es igual al de cargas negativas, compuesto es neutro.
La fórmula que habitualmente se da es una fórmula empírica.
Propiedades
• Temperaturas de fusión y ebullición muy elevadas. Sólidos a temperatura ambiente. La red
cristalina es muy estable por lo que resulta muy difícil romperla.
• Son duros (resistentes al rayado).
• No conducen la electricidad en estado sólido, los iones en la red cristalina están en posiciones
fijas, no quedan partículas libres que puedan conducir la corriente eléctrica.
• Son solubles en agua por lo general, los iones quedan libres al disolverse y puede conducir la
electricidad en dicha situación.
• Al fundirse también se liberan de sus posiciones fijas los iones, pudiendo conducir la
electricidad.
Estructura de Lewis:
Ejemplo: Enlace iónico entre el cloro y el sodio

Página 10 de 14
Enlace covalente. Consideraciones básicas
¿Qué es el enlace covalente?
Es el enlace que se da entre elementos de electronegatividades altas y muy parecidas, en estos casos
ninguno de los átomos tiene más posibilidades que el otro de perder o ganar los electrones. La forma
de cumplir la regla de octeto es mediante la compartición de electrones entre dos átomos. Cada par de
electrones que se comparten es un enlace.
Este tipo de enlace se produce entre elementos muy electronegativos (no metales).
Los electrones que se comparten se encuentran localizados entre los átomos que los comparten.
¿Qué mantiene la unión?
La fuerza de atracción entre las cargas positivas de los núcleos y las cargas negativas de los electrones
que se comparten.
¿Se forman moléculas?
Tenemos moléculas como tales en el caso de las sustancias moleculares. Si los átomos que se unen
con enlace covalente forman 'sólidos covalentes' o 'redes covalentes', no tendremos moléculas como
tales entidades que se puedan aislar.
Sustancias moleculares
Están constituidas de moléculas; es decir, agrupaciones de un número concreto de átomos que se
encuentran unidos dos a dos mediante enlace covalente. Se representa mediante la fórmula molecular.
Son las únicas sustancias que podemos considerar que tienen moléculas como tales entes que se
pueden aislar.
Propiedades.
Son las habituales de los enlaces covalentes:

Página 11 de 14
• Temperaturas de fusión bajas. A temperatura ambiente se encuentran en estado gaseoso, líquido
(volátil) o sólido de bajo punto de fusión.
• Las temperaturas de ebullición son igualmente bajas.
• No conducen la electricidad en ningún estado físico dado que los electrones del enlace están
fuertemente localizados y atraídos por los dos núcleos de los átomos que los comparten.
• Son muy malos conductores del calor.
• La mayoría son poco solubles en agua. Cuando se disuelven en agua no se forman iones dado
que el enlace covalente no los forma, por tanto, si se disuelven tampoco conducen la
electricidad.
Sólidos covalentes o redes covalentes
En los sólidos covalentes no se forman moléculas. Los enlaces covalentes permiten asociaciones de
grandes e indeterminadas cantidades de átomos iguales o diferentes cuando esto ocurre no se puede
hablar de moléculas, sino de redes cristales covalentes. La fórmula de las redes covalentes es al igual
que la de las sustancias iónicas, una fórmula empírica.
Propiedades
Algunas son similares a las de las sustancias moleculares
• No conducen el calor ni la electricidad.
• Son insolubles en agua.
A diferencia de las sustancias moleculares:
• Presentan temperaturas de fusión y ebullición muy elevadas. Son sólidos a temperatura
ambiente.
• Son muy duros (resistencia a ser rayado).
Estructura de Lewis:
Enlace metálico. Consideraciones básicas
¿Qué es el enlace metálico?
Es el enlace que se da entre elementos de electronegatividades bajas y muy parecidas, en estos casos
ninguno de los átomos tiene más posibilidades que el otro de perder o ganar los electrones. La forma
de cumplir la regla de octeto es mediante la compartición de electrones entre muchos átomos. Se crea
una nube de electrones que es compartida por todos los núcleos de los átomos que ceden electrones al
conjunto.
Este tipo de enlace se produce entre elementos poco electronegativos (metales).
Los electrones que se comparten se encuentran deslocalizados entre los átomos que los comparten.
¿Qué mantiene la unión?
La fuerza de atracción entre las cargas positivas de los núcleos y las cargas negativas de la nube de
electrones.

Página 12 de 14
Propiedades
• Temperaturas de fusión y ebullición muy elevadas. Son sólidos a temperatura ambiente (excepto
el mercurio que es líquido).
• Buenos conductores de la electricidad (nube de electrones deslocalizada) y del calor (facilidad
de movimiento de electrones y de vibración de los restos atómicos positivos).
• Son dúctiles (facilidad de formar hilos) y maleables (facilidad de formar láminas) al aplicar
presión. Esto no ocurre en los sólidos iónicos ni en los sólidos covalentes dado que al aplicar
presión en estos casos, la estructura cristalina se rompe.
• Son en general duros (resistentes al rayado).
• La mayoría se oxida con facilidad.
Aleaciones
Las aleaciones se forman de la combinación de un metal más otro metal. La aleación de dos metales es
de gran importancia ya que es una de las principales formas de modificar las propiedades de los
elementos metálicos puros.
Análisis del tipo de enlace más probable. Según el tipo de átomos que forman las sustancia
• Si se produce entre elementos que tienen muy diferente electronegatividad, entre metales (baja
electronegatividad) y no metales (alta electronegatividad): Enlace iónico.
• Si se produce entre elementos que tienen alta electronegatividad, pero muy parecida (no metal
con no metal): Enlace covalente.
• Si se produce entre elementos que tienen baja electronegatividad y muy parecida (metal con
metal): Enlace metálico.
Según las propiedades de la sustancia
Por ejemplo, se puede utilizar una tabla como la siguiente y analizar dónde se produce el mayor
número de respuestas afirmativas:
Enlace covalente
Enlace iónico Enlace
metálico Sustancia
molecular
Sólido
covalente
¿Alto punto de fusión y ebullición? No Sí Sí Sí
¿Conduce electricidad? No No No Sí
¿Conduce la electricidad en estado líquido
(fundido)? No No Sí Sí
¿Conduce la electricidad al disolverse en agua? No No Sí --
¿Se disuelve en agua? Algunas No Sí --
¿Maleabilidad y ductilidad? No No No Sí
¿Duro? No Sí Sí Si - No
Fórmulas químicas
La fórmula química es la representación simbólica de las formas que adoptan los elementos para
formar una molécula.
Fórmula molecular.
• La fórmula molecular indica la cantidad exacta de átomos de cada elemento que está presente en
la unidad más pequeña de una sustancia.
• Son las fórmulas verdaderas de las moléculas.
Fórmula empírica
• La fórmula empírica indica los elementos que están presentes en la sustancia y la proporción en
que se encuentran, expresada en números enteros lo más pequeños posibles.
• Coincide con la fórmula molecular cuando las sustancias presentan moléculas aisladas
(sustancias moleculares). En algunos casos (sustancias orgánicas habitualmente) la fórmula
molecular es un múltiplo de la fórmula empírica.

Página 13 de 14
TABLA PERIÓDICA
Metales, no metales, gases nobles Una primera clasificación de la tabla es entre Metales, No Metales y Gases Nobles. La mayor parte de
los elementos de la tabla periódica son metales.
Observa que puedes seguir una pauta muy sencilla para estudiar los no metales.
• Los no metales comienzan en el grupo de los térreos con el primero (B).
• La siguiente columna (grupo de los carbonoideos) son dos (C y Si).
• La siguiente columna (grupo nitrogenoideos) son tres (N, P y As).
• La siguiente columna (anfígenos) son cuatro (O, S, Se y Te).
• La siguiente columna (halógenos) son cinco (F, Cl, Br, I y At).
• Sólo queda el hidrógeno (H) que suele considerarse no metal.
Aprendiendo los no metales y la columna de los gases nobles, podrás saber si un elemento determinado
es metal, no metal o gas noble: no metal o gas noble por haberlo estudiado, metal por exclusión. Este
conocimiento resulta de importancia en la predicción del tipo de enlace entre átomos.
Tipos de elementos 1. Los metales los solemos clasificar de la siguiente forma:
o Metales reactivos. Se denomina así a los elementos de las dos primeras columnas
(alcalinos y alcalinotérreos) al ser los metales más reactivos por regla general.
o Metales de transición. Son los elementos que se encuentran entre las columnas largas,
tenemos los de transición interna (grupos cortos) y transición externa o tierras raras
(lantánidos y actínidos).
o Otros metales. Son los que se encuentran en el resto de grupos largos. Algunos de ellos
tienen propiedades de no metal en determinadas circunstancias (semimetales o
metaloides).
2. Los no metales, algunos de los cuales, los que se encuentran cerca de la línea de separación metal
/ no metal, tienen un comportamiento metálico en determinadas circunstancias (semimetales o
metaloides).

Página 14 de 14
3. Gases Nobles o gases inertes.