Unidad 1: Enlace Químicopreuniversitarioportezuelo.cl/wp-content/uploads/2019/06/...de valencia,...
Transcript of Unidad 1: Enlace Químicopreuniversitarioportezuelo.cl/wp-content/uploads/2019/06/...de valencia,...

PropiedadesdeloscompuestosIónicos Covalentes Metálicos
- Son sólidos con puntos defusiónyebulliciónaltos.
- Durosyquebradizos.
- Solubles en disolventespolares,comoelagua.
- Conducenbienlaelectricidadendisoluciónacuosa.
- Songases,líquidososólidosconpuntodefusiónbajos.
- Solubles en disolventes nopolares, como el hexano,benceno, tetracloruro decarbono,entreotros.
- Los compuestos líquidoso fundidos no conducen laelectricidad.
- Sondúctilesymaleables.
- Buenos conductores de laelectricidad.
- Conducen el calor y tienenpuntos de ebullición y fusiónvariables.
- Presentanunbrillocaracterístico.
- En general, insolubles encualquiertipodedisolvente.
Iónico → Es la unión resultante de la presencia de fuerzas electroestáticas entre iones positivos y negativos para dar lugar a la formación de un compuesto constituido por una red cristalina iónica. Se caracteriza por la transferencia de electrones desde un átomo hacia otro, como consecuencia de la elevada diferencia de electronegatividad entre ambos.
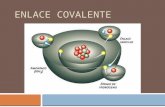
Covalente → Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos. El enlace se forma al compartirse un par de electrones entre los dos átomos. Los enlaces covalentes se pueden clasificar según el tipo de átomos que los forman:
Apolar: aquel enlace que está formado por dos átomos iguales. La tendencia a llevarse los electrones sobre sí es igual y no presentan diferencia de electronegatividad.
•
Polar: aquel enlace que está formado por dos átomos diferentes. Dependiendo de la mayor o menor diferencia de electronegatividad entre los átomos, dará lugar a enlaces más o menos polarizados.
•
Dativo: corresponde a un enlace covalente en el que cada par de electrones compartido por dos átomos es aportado por uno de ellos.
•
Metálico → Es un enlace fuerte, primario, que se forma entre elementos de la misma especie, de electronegatividades bajas y que se diferencien poco.
Resumen Química Común.
Unidad 1: Enlace Químico

Teoría de repulsión de los pares electrónicos de la capa de valencia (TRPECV)
ElmodelodeLewisfuesolounaprimeraaproximaciónalestudiodelenlacecovalente.Sinembargo,noresolvíacuestionescomo:
• Porquélacomparticióndeelectronesllevaaunauniónestable.
• Porquéunoselectronesdevalenciasonenlazantesyotrosno.
• Quédeterminalaformageométricadelasmoléculas
• Porquéunosenlacessonmásfuertesqueotros.
Conlaintroduccióndelmodelomecánico-cuánticofueposibledarrespuestas.Segúnlateoríadelenlacedevalencia,paraqueseformeunenlacecovalentetípicoentredosátomos,handeinteraccionarysolaparseunorbitaldeunodelosátomosconunorbitaldelotroyparaqueelloseaposible,cadaorbitaldebeestarocupadoporunsoloelectrónyademásdeespinesopuestos.
Geometríadelasmoléculassinparesdeelectroneslibresenelátomocentral2paresenlaceLINEAL
5paresenlaceBIPIRÁMIDETRIGONAL
6paresenlaceOCTAÉDRICA
3paresenlaceTRIGONALPLANA
4paresenlaceTETRAÉDRICA
180º
90º
120º
120º 109,5º
90º
Fuerzas intermoleculares
Estas fuerzassondedistinta intensidadymantienenmásomenosunidasa lasmoléculasentresí,determinandolaspropiedadesdelassustancias,talescomo:estadodeagregación,puntodeebullición,etc.
Lasfuerzasdeatracciónintermolecularpuedenserdedostipos:fuerzasdeVanderWaals(fuerzasdipolo–dipolopermanente,fuerzasdipolopermanente–dipoloinducidoyfuerzasdedispersiónodeLondon)yenlaceporpuentedehidrógeno.
Sonenlacesconsiderablementemásdébilesquelosintramoleculares(iónicos,covalentesymetálicos).

Leyes de la estequiometría
• Ley de conservación de la masa (ley de Lavoisier): En una reacción química la masa permanece constante, es decir, la masa de los reactantes será igual a la de productos. Por ejemplo, en la reacción de formación del agua: 2H2 + O2 → 2H2O, cuando 4 gramos de hidrógeno reaccionan con 32 gramos de oxígeno, se forman 36 gramos de agua.
• Ley de las proporciones deinidas (ley de Proust): En un compuesto dado, los elementos participantes se combinan siempre en la misma proporción, sin importar su origen y modo de obtención. Por ejemplo, en el óxido de cinc (ZnO) siempre hay un átomo de cinc por cada átomo de oxígeno y la proporción de masas es 80,3% de cinc y 19,7% de oxígeno.
• Ley de las proporciones múltiples (ley de Dalton): Cuando dos o más elementos se combinan para dar más de un compuesto, las masas de uno de ellos, que se unen a una masa ija del otro, tienen como relación números enteros y sencillos. Por ejemplo, en los anhídridos de nitrógeno (N2O, NO, N2O3, NO2 y N2O5), si se ija la masa de oxígeno en 7 g, las masas de nitrógeno en cada compuesto son, respectivamente, 4 : 8 : 12 : 16 : 20, o simpliicando, 1 : 2 : 3 : 4 : 5.
Conceptos estequiométricos
• Mol: es la cantidad de una sustancia que contiene tantas entidades elementales (átomos, moléculas u otras partículas) como átomos hay exactamente en 12 g del isótopo de carbono-12.
• Número de Avogadro (NA): número de entidades elementales que hay en un mol. Este número se determina experimentalmente y su valor es de 6,02 x 1023.
Al igual que una docena de naranjas contiene 12 naranjas, un mol de átomos de H contiene 6,02 x 1023 átomos y un mol de moléculas de CO2, 6,02 x 1023 moléculas.
• Unidad de masa atómica (uma o u): unidad utilizada para expresar la masa de un átomo. Equivale a la duodécima parte (1/12) de la masa de un átomo de carbono-12.
1 uma = 1,66 x 10─24 g
La estequiometría (del griego stoicheion, “elemento” y métrón, “medida”) es el cálculo de las proporciones cuantitativas o relaciones de masa entre los reactantes y productos en el transcurso de una reacción química.
Unidad 2: Estequimetría y Reacciones Químicas.

• Masa atómica (o peso atómico): masa de un átomo, en unidades de masa atómica (uma). Por ejemplo, la masa atómica del oxígeno (O) es 16,0 uma.
• Masa molecular (o peso molecular): masa de una molécula (suma de las masas atómicas, en uma). Por ejemplo, la masa molecular del SO2 es 64 uma (32 uma + 2 x 16 uma).
• Masa molar: masa (en gramos) de 1 mol de unidades (átomos o moléculas) de una sustancia. Por ejemplo, la masa molar del SO2 es 64 g/mol (32 g/mol + 2 x 16 g/mol).
Para cualquier átomo o molécula:masa atómica o molecular (uma) = masa molar (gramos)
+
Un átomo de C(12 uma)
Una molécula de O2(32 uma)
Una molécula de CO2(44 uma)
A nivel molecular
+
12 g de carbonoen un vidrio de reloj
32 g de oxígenoen un globo
44 g de dióxido de carbonoen un globo
A nivel macroscópico
Es útil recordar la relación que existe entre número de moles (n), masa en gramos (m) y masa molar (MM):
mMMn =
Que también se puede expresar como:
m = n ∙ MM

Masa molar(g/mol)
1 mol6,02x1023
partículasVolumen
gases (en C.N.P.T.) =
22,4 L
• Composición porcentual: informa sobre el porcentaje de cada elemento presente en un compuesto. Para calcularla, se debe considerar la masa molar del compuesto como el 100%. Por ejemplo, para determinar el porcentaje de hidrógeno presente en el agua (H2O), cuya masa molar es 18 g/mol, hay que realizar el siguiente cálculo utilizando la masa molar del hidrógeno (1 g/mol):
18 g/mol → 100%
2 g/mol → X X = 11,11% de hidrógeno

a A + b B → c C + d D
donde:
A y B representan los símbolos químicos de los átomos o moléculas que reaccionan (reactantes).
C y D representan los símbolos químicos de los átomos o moléculas que se obtienen (productos).
a, b, c y d representan los coeicientes estequiométricos, que indican el número de átomos, moléculas o moles de cada sustancia, involucrados en la reacción, por lo que pueden ser números enteros o fracciones y varían de acuerdo a la cantidad de sustancia. Se denominan coeicientes atómicos, los subíndices (no presentes en la ecuación planteada) que pueden acompañar a cada símbolo y que indican el número de átomos del elemento. Estos corresponden siempre a números enteros y son invariables para una determinada molécula.
Adicionalmente, se puede agregar entre paréntesis el estado físico de cada sustancia participante, de la siguiente manera: sólido (s), líquido (l), acuoso (ac) o gaseoso (g).
Por ejemplo, la siguiente ecuación balanceada corresponde a la reacción de formación de agua (H2O) a partir de hidrógeno (H2) y oxígeno (O2):
2 H2 (g) + O2 (g) → 2 H2O (l)
Esta ecuación se puede interpretar en términos microscópicos (átomos o moléculas) o macroscópicos (moles):
1. 2 moléculas de hidrógeno gaseoso (H2) reaccionan con 2 moléculas de oxígeno gaseoso (O2) produciendo 2 moléculas de agua líquida (H2O).
2. 2 moles de hidrógeno gaseoso (H2) reaccionan con 2 moles de oxígeno gaseoso (O2) produciendo 2 moles de agua líquida (H2O).
También se puede interpretar la ecuación en términos de masa, ya que a partir de las masas molares se puede calcular la cantidad en gramos de cada sustancia. Por lo que tenemos una tercera forma de leer la ecuación:
Una reacción química (o cambio químico) es un proceso en el cual una o más sustancias, denominadas reactivos o reactantes, se transforman en otras sustancias llamadas productos.
La descripción simbólica de una reacción química se conoce como ecuación química.
Interpretación de una ecuación química
Para una ecuación química general, tenemos:

3. 4 gramos de hidrógeno (2 x M.at. H x 2) reaccionan con 32 gramos de oxígeno (M.at. O x 2) produciendo 36 gramos de agua (2 x M.M. H2O).
Para resolver ejercicios que involucren reacciones químicas, debemos considerar estas relaciones entre las cantidades de las distintas sustancias involucradas, trabajando preferentemente en moles. Para ello, la ecuación debe estar siempre correctamente balanceada, como veremos a continuación.
Balance de una ecuación química
Una ecuación química debe relejar lo que ocurre en el transcurso de la reacción. Por lo tanto, debe respetar las leyes de conservación de la masa y de la carga total. Para ello, debe estar correctamente balanceada. Una ecuación se balancea (ajusta o equilibra) cambiando los coeicientes estequiométricos (números que anteceden las formulas), hasta igualar el número de átomos en ambos lados de la ecuación.
Por ejemplo, para la reacción de combustión del propano, la ecuación sin ajustar será:
C3H8 + O2 → CO2 + H2O
Esta ecuación no cumple con la ley de conservación de la materia, puesto que para el carbono (C) por ejemplo, hay 3 átomos en los reactantes y solo 1 en los productos. Por lo tanto, hay que ajustar la ecuación introduciendo delante de cada compuesto el coeiciente estequiométrico adecuado.
De esta manera, el número de átomos de carbono se puede ajustar anteponiendo un 3 en el CO2. Y el número de átomos de hidrógeno (H), se ajusta colocando un 4 delante del H2O.
C3H8 + O2 → 3 CO2 + 4 H2O
Finalmente, para ajustar el número de átomos de oxígeno (O), se antepone un 5 en el O2.
C3H8 + 5 O2 → 3 CO2 + 4 H2O
Reactivos limitante y en exceso
El reactivo limitante es aquel que limita la reacción. Es decir, una vez que este reactivo se acaba, termina la reacción. Los reactivos que sobran se llaman reactivos en exceso (excedentes).
Por lo tanto, la cantidad de producto que se forme depende de la cantidad de reactivo limitante.
Por ejemplo, en la siguiente reacción icticia, A es el reactivo limitante, que determina la cantidad del producto AB que puede formarse. Mientras que B es el reactivo en exceso.
+
3 A 5 B 3 AB 2B
+

• Suspensión: está formada por un sólido en polvo (soluto) o pequeñas partículas no solubles (fase dispersa) que se dispersan en un medio líquido (fase dispersante).
• Coloide: es un sistema fisicoquímico formado por dos o más fases, principalmente, una continua, normalmente fluida, y otra dispersa en forma de partículas, por lo general sólidas. La fase dispersa es la que se halla en menor proporción (menor cantidad y volumen) en la mezcla o materia. Ejemplo de un coloide corresponde a la espuma de una cerveza.
• Emulsión: corresponde a una mezcla de líquidos inmiscibles de manera más o menos homogénea. Ejemplos de emulsiones son: la mantequilla, margarina, leche, crema, mayonesa, entre otras.
Un material es homogéneo cuando se presenta uniforme en toda su extensión, es decir, todas sus partes son idénticas en cuanto a color, dureza, densidad, etc. Por lo tanto, está formado por una sola fase.
Disolución
Una disolución es una mezcla homogénea de uno o más solutos (sustancia disuelta) distribuidos en un disolvente (sustancia que produce la disolución) y que se encuentra en mayor proporción o que determina el estado de agregación en el que se encuentra la disolución.
Cuando se agrega una cierta cantidad de azúcar al agua, se puede observar que esta sustancia se va disolviendo lentamente en el líquido. Luego de un tiempo determinado, el material obtenido se presenta homogéneo, lo que constituye una disolución. Al agregar mayor cantidad de azúcar al mismo volumen de agua, se aprecia que continúa el proceso de disolución, sin embargo, llegará un momento en el que el agua no podrá disolver más sólido.
A esta característica que presentan las sustancias se le denomina solubilidad y nos indica la cantidad de una sustancia que se puede disolver en una cantidad específica de disolvente, a una temperatura y presión determinada.
Ahora bien, si se quiere separar los componentes de una disolución se deben utilizar técnicas de tipo físico como la cromatografía, la destilación, cristalización, entre otras. A continuación se detallan algunas:
Unidad 3: Disoluciones
Cuando examinamos los materiales a simple vista o con la ayuda de un microscopio, podemos apreciar que la mayoría de ellos constituyen una mezcla. En general, las mezclas son dos o más sustancias que forman un sistema en el cual no hay enlaces químicos y se clasifican en homogéneas y heterogéneas.
Un material es heterogéneo si presenta regiones visibles que difieren unas de otras en sus propiedades, es decir, está formado por dos o más fases. Dentro de estas mezclas heterogéneas, se encuentran:

• Destilación: procedimiento de separación de los componentes líquidos de una disolución, que se basa en la diferencia en sus puntos de ebullición. En la práctica se utiliza un aparato como el que se muestra en la figura para separar líquidos volátiles.
• Evaporación: también denominada vaporización, es el proceso en el cual un líquido se transforma en un gas. En este caso solo un componente es de interés (al contrario de lo que ocurre en una destilación). Se puede realizar por calentamiento o por presión reducida.
Vapor de agua
Disolución acuosa de sulfato de sodio
• Decantación: método de separación de tipo mecánico utilizado
para separar dos líquidos inmiscibles, por ejemplo agua y aceite, o también para separar una mezcla formada por un sólido y un líquido. Se basa en la diferencia de densidades entre los dos componentes.
Fase 1
Decantación
Llave
Fase 2
Termómetro
Refrigerante
Destilado

• Filtración: método de separación de mezclas en el cual se separan los sólidos de los líquidos utilizando paredes o capas porosas, cuyos poros dejan pasar el líquido y retienen los sólidos.
• Tamizado: método físico para separar mezclas de diferentes tamaños al hacerlos pasar por un tamiz (colador). Es un método utilizado generalmente en mezclas de sólidos heterogéneos.
Tipos de disoluciones
Dependiendo del número de componentes:
• Binaria• Ternaria• Cuaternaria
Dependiendo de la naturaleza de la fase:
• Sólida• Líquida• Gaseosa
Papel de iltro
Embudo

Dependiendo de la naturaleza del soluto
• Electrolíticas (iónicas): soluto se disocia en iones (Ej. NaCl). Conducen la corriente eléctrica.• No electrolíticas (moleculares): soluto no se disocia en iones (Ej. azúcar). No conducen la corriente
eléctrica.
Tipos de disoluciones según el estado físico
Estado de la disolución Estado del disolvente Estado del soluto EjemploGas Gas Gas Aire
Líquido Líquido Gas O2 en H2OLíquido Líquido Líquido Alcohol en H2OLíquido Líquido Sólido Sal en H2OSólido Sólido Gas H2 en PdSólido Sólido Líquido Hg en AgSólido Sólido Sólido Ag en Au
Unidades de concentración
La concentración de una disolución es una medida de la cantidad de soluto que hay en ella. Se pude expresar de distintas formas. Dentro de estas formas, están las unidades porcentuales o físicas:
A) Porcentaje en masa (% m/m): X g de soluto en 100 g de disolución.
El porcentaje en masa (también llamado porcentaje en peso o peso porcentual) es la relación de la masa de un soluto en la masa de la disolución, multiplicado por 100%. No tiene unidades porque es una relación de cantidades semejantes.
% m/m = x 100masa (g) de solutomasa (g) de disolución
B) Porcentaje masa/volumen (% m/v): X g de soluto en 100 mL de disolución.
El porcentaje masa/volumen es la relación de la masa de un soluto en un volumen de disolución, multiplicado por 100%. No tiene unidades porque es una relación de cantidades semejantes.
% m/v = x 100masa (g) de solutovolumen (mL) de disolución
C) Porcentaje volumen/volumen (% v/v): X mL de soluto en 100 mL de disolución.
El porcentaje volumen/volumen es la relación del volumen de un soluto en un volumen de disolución, multiplicado por 100%. No tiene unidades porque es una relación de cantidades semejantes.
% v/v = x 100volumen (mL) de solutovolumen (mL) de disolución

M = moles de soluto
litros de disolución
X moles de soluto →1000 mL de disolución
Por ejemplo, si se disuelven 3 moles de soluto en una cantidad adecuada de disolvente hasta completar 1000 mL de disolución, se tiene una concentración 3 molar (3 M) de esa disolución.
Para preparar estas disoluciones, generalmente se disuelve primero el soluto en un volumen menor de disolvente. Esta disolución se traslada a un matraz aforado y luego se enrasa o afora con más disolvente hasta completar el litro de disolución.
Se debe recordar que:
n =m
MM
Este parámetro es el más común para expresar la concentración en química, aunque tiene el inconveniente de que varía con la temperatura, debido al cambio de volumen en función de esta (dilatación térmica).
Molalidad
Se denota por una m minúscula y expresa el número de moles de soluto por kilogramo de disolvente. Su fórmula es:
m = moles de solutokilogramos de disolvente
X moles de soluto →1000 g de disolvente
La forma más usual para expresar la concentración de una disolución es por medio de unidades químicas. Estas se diferencian de las unidades físicas en que están referidas a los moles de las especies involucradas en la disolución. Entre las unidades químicas más utilizadas tenemos la molaridad, la molalidad y la fracción molar.
Molaridad
Se denota por una M mayúscula e indica el número de moles de soluto contenidos en cada litro de disolución. Su fórmula es:

Por ejemplo, si se disuelven 2 moles de soluto en un kilogramo de agua (equivalente a un litro, ya que la densidad del agua es 1 kg/L), se obtiene una disolución de concentración 2 molal (2 m).
Para preparar disoluciones molales, se utilizan vasos de precipitado y una balanza analítica para pesar el soluto y el kilogramo de disolvente, los que luego se mezclan para obtener la disolución deseada.
La principal ventaja de este método con respecto a la molaridad es que no está en función del volumen, por lo tanto, es independiente de la temperatura y la presión.
Si se quiere relacionar la molalidad con la molaridad se requiere conocer la densidad de la disolución. Se debe recordar que:
d= mV
Fracción molar
Es una unidad que expresa la cantidad de moles de cada componente en relación a la totalidad de los moles de disolución. Corresponde a una unidad adimensional.
Xii= <1nint
Donde ni es el número de moles de un determinado soluto (o disolvente) y nt es el número total de moles de la disolución.
Todas las fracciones molares de una disolución serán siempre menores que 1 y su suma dará como resultado 1.
Xi1 + Xi2 + … + Xin = 1
Esta unidad es apropiada para trabajar con disoluciones gaseosas, ya que en los gases ideales hay una relación directa entre las fracciones molares y los volúmenes y presiones parciales.
Otras unidades de concentración
Para expresar concentraciones muy pequeñas, trazas de una sustancia muy diluida en otra, es común utilizar otras unidades de concentración, tales como: partes por millón (ppm), partes por billón (ppb) y partes por trillón (ppt).
La más utilizada corresponde a partes por millón, que se expresa de la siguiente manera:
ppm = x106 →masa soluto
masa disoluciónmasa soluto (mg)
masa disolución (kg)
En el caso de disoluciones acuosas, una parte por millón (1 ppm) equivale a un miligramo (mg) de soluto por litro (L) de disolución.

S= gsoluto100mLdisolvente
Dadoqueeltérminosolubilidadseutilizatantoparadesignaralfenómenocualitativodelprocesodedisolucióncomoparaexpresarcuantitativamentelaconcentracióndelasdisoluciones,podemostenertrestiposdedisoluciones:
1. Disolución insaturada:serefiereaunadisolucióndondeeldisolventepuedeseguirdisolviendoalsoluto.Sedistingueunasolafase.
Dilución
Es el procedimiento que se sigue para preparar una disolución menos concentrada a partir de una más concentrada. Al efectuar un proceso de dilución, conviene recordar que al agregar más disolvente a una cantidad dada de la disolución concentrada, su concentración cambia (disminuye) sin que cambie el número de moles de soluto presente en la disolución. En otras palabras:
moles (n) de soluto antes de la dilución = moles (n) de soluto después de la dilución
Como todo el soluto proviene de la disolución concentrada original, se concluye que:
=C1⋅V1
mmoles de soluto antes de la dilución
C2⋅V2
mmoles de soluto después de la dilución
Donde:
C1: concentración molar de la disolución inicial; C2: concentración molar de la disolución final
V1: volumen de la disolución inicial; V2: volumen de la disolución final
Solubilidad
La solubilidad es una medida adimensional que representa la capacidad de una determinada sustancia para disolverse en otra y depende de una serie de factores como son, la naturaleza del disolvente y del soluto, la temperatura y la presión del sistema.
Esta expresión adimensional se representa con una letra S e indica la máxima cantidad de soluto que se puede disolver en 100 mL de agua. Por ejemplo, la solubilidad del nitrato plumboso (Pb(NO3)2), a 20 °C es de 0,5, lo que significa que se pueden disolver como máximo 50 gramos de esta sal en 100 gramos de agua. Se puede calcular mediante la fórmula:

2. Disolución saturada:esunadisoluciónquehallegadoalmáximopermitido,esdecir,eldisolventenopuededisolvermayorcantidaddesoluto.
3. Disolución sobresaturada:enestecaso,eldisolventeseveforzadoadisolvermássolutodeloquenormalmentepuede.Esto sedebeaqueal aumentar la temperaturade lamezcladedisoluciónsaturadaconsolutocristalizadoalfondo,ladisoluciónsaturadaaceptamáscantidaddesoluto,desapareciendoelexcesodesolutonodisuelto,dejandodesermezclayconvirtiéndoseenunadisolución(unafase).Ahora,siestadisoluciónseenfría,aúnsolubilizandoeseexcesodesoluto(sinperturbacionesexternas),seconvierteenunadisoluciónsobresaturada.
Reglas de solubilidad para compuestos iónicos en agua a 25 °CCompuestossolubles Excepciones
• Compuestos que contengan iones demetalesalcalinosyelionamonio(NH4
+).
• Nitratos (NO3–), bicarbonatos (HCO3
–) ycloratos(ClO3
–).
• Halogenuros(Cl–,Br–,I–).
• Sulfatos(SO42–).
• HalogenurosdeAg+,Hg2+yPb2+.
• SulfatosdeAg+,Ca2+,Sr2+,Ba2+,Hg2+yPb2+.
Compuestosinsolubles Excepciones• Carbonatos (CO3
–), fosfatos (PO43–),
cromatos(CrO42–),sulfuros(S2–).
• Hidróxidos(OH–).
• Compuestos que contengan iones demetalesalcalinosyelionamonio.
• Compuestos que contengan iones demetalesalcalinosyelionBa2+.
Propiedades coligativas
Cuandoseañadeunsolutoaundisolvente,algunaspropiedadesdeestequedanmodificadas,tantomáscuantomayoreslaconcentracióndeladisoluciónresultante.Estaspropiedades(presióndevapor,puntodecongelación,puntodeebulliciónypresiónosmótica)sedenominancoligativaspordependerúnicamentedelaconcentracióndesoluto;nodependendelanaturalezaodeltamañodelasmoléculasdisueltas.Laspropiedadescoligativaspermitendeterminarmasasmoleculares.
• Disminución de presión de vapor
Aunadeterminadatemperatura,lapresióndevapordeunadisolucióndeunsolutonovolátilesmenorqueladeldisolventepuro.LaleydeRoultexpresaladependenciadeestavariaciónconlaconcentración.Suexpresiónmatemáticaes:
p0− p=Xs⋅p0
p=presióndevapordeladisolución.
p0=presióndevapordeldisolventepuro.
Xs=fracciónmolardesoluto.

• Ascenso ebulloscópico
Sellamaascensoebulloscópico,Δte,alaumentodelatemperaturadeebullicióndeundisolventecuandose leañadeunsoluto.Estavariacióndependede lanaturalezadeldisolventeyde laconcentracióndesoluto.Elascensoebulloscópicovienedadoporlaexpresión:
Δte=t−te=ke⋅ m
t=temperaturadeebullicióndeladisolución.
te=temperaturadeebullicióndeldisolventepuro.
Ke=constanteebulloscopicamolaldeldisolvente.
m=molalidaddeladisolución.
• Descenso crioscópico
Sellamadescensocrioscópico,∆tc,aladisminucióndelatemperaturadefusión(odecongelación)de un disolvente cuando se le añadeun soluto.Esta variación dependede la naturaleza deldisolventeydelaconcentracióndesoluto.Eldescensocrioscópicovienedadoporlaexpresión:
Δtc=tc−t=kc⋅ m
t=temperaturadecongelacióndeladisolución.
tc=temperaturadecongelacióndeldisolventepuro.
Kc=constantecrioscópicamolaldeldisolvente.
m=molalidaddeladisolución.
• Presión osmótica
Es la presión que se ejerce sobre una disolución para impedir su dilución, cuando pasa undisolvente puro a través de unamembrana semipermeable. Su expresión viene dada por laecuacióndeVan’tHoff.
π ⋅ V=n⋅ R⋅T
π=presiónosmóticaenatmósferas.
V=volumendeladisoluciónenlitros.
n=númerodemolesdesoluto.
R=0,082(atm⋅L/K⋅mol).
T=temperaturaabsoluta(K).

Loscombustibles fósilessonsustanciasquímicascongranpoderenergéticoasociado,quesurgendelastransformacionesdelabiomasaterrestrepresentedesdehacemillonesdeañosocurridasenlaTierra,apartirderestos orgánicosdeplantasyanimalesmuertosdepositadosenelfondodelosmaresyotroscuerposdeagua.Estastransformacionessucedenporladescomposicióndelabiomasaaaltísimaspresionesyenotrascondicionesparticulares.
Correspondenarecursosno renovablesyaqueseestánagotandoaunritmomuchomayorqueeldesuformación.
Loscombustiblesfósilesseasocianalcarbono,elementoqueformapartedetodoslosseresvivos,elcuálseencuentraenlanaturalezacomounmineralnegro,procedentedelasmateriasvegetalesdescompuestas.Seencuentratambiéncomografitoydiamanteendistintasdisposicionesgeométricas.Correspondenacombustiblesfósiles:el petróleo, carbón y gas natural.
Diamante Grafito
Carbón
El carbón es un mineral negro procedente de materia vegetal descompuesta y acumulada desdeépocasprehistóricas,sometidaaaltísimaspresionesporacciónderocassedimentariasqueimpidieronelcontactoconelaireylaposteriorcompresiónenlechosduros.Elcarbónno es carbono puro,sinoqueposeetambiénporcentajesdeH2,N2,O2yS.Elmáspuroencarbonoeslaantracita.
Tipo de carbón Grado de pureza (% de carbono)Antracita 85-95%
Hulla 78%aprox.Turba 60-70%
IV. Unidad Química Orgánica
Combustibles fósiles

Uno de los elementos químicos más versátiles que se encuentra en la naturaleza es el carbono, debido a la capacidad que tiene para formar variados compuestos, tanto orgánicos como inorgánicos.
Dada la hibridación de sus orbitales s y p, cuando se unen dos o más átomos de carbono lo pueden hacer a través de enlaces simples, dobles o triples, lo cual explica la enorme cantidad de compuestos orgánicos existentes. Los más simples son los denominados hidrocarburos, puesto que están constituidos solo por carbono e hidrógeno. Si la estructura de estos compuestos es una cadena abierta, se clasifican como alifáticos y, si la cadena es cerrada, como alicíclicos. Cuando un compuesto de cadena cerrada presenta enlaces simples y dobles en forma alternada, se denominan aromáticos.
Cuando la unión entre los átomos de carbono es simple, los compuestos alifáticos se denominan alcanos. Si existe una unión doble, hablaremos de alquenos y si existe un enlace triple, serán alquinos.
La principal fuente de obtención de estos compuestos es el petróleo, el que luego de ser sometido a una destilación fraccionada, da como resultado una serie de hidrocarburos gaseosos, líquidos y sólidos que serán utilizados principalmente como combustibles o materias primas para la obtención de otros productos.
Propiedades del carbono
El carbono por su posición en la tabla periódica y con cuatro electrones de valencia, no es muy electronegativo, ni tampoco muy electropositivo, de este modo, el carbono se une a otros elementos, principalmente compartiendo pares de electrones, es decir, por enlaces covalentes. Sin embargo, la característica más llamativa del carbono es la capacidad de unirse a otros átomos formando cadenas largas estables.
Hidrocarburos alifáticos y aromáticos
Las moléculas orgánicas están formadas por un esqueleto de átomos de carbono con átomos de hidrógeno, que puede llevar además otros tipos de átomos.
Estas moléculas formadas por C e H reciben el nombre de Hidrocarburos y son los más simples de los compuestos orgánicos. Estos se clasifican en:

Alifáticos
Saturados Alcanos → Formula molecular general CnH2n+2
H H
H H
H HC C
InsaturadosAlquenos → Formula molecular general CnH2n
H
H H H
HC = C − C − H
Alquinos → Formula molecular general CnH2n−2 H3C − CH2 − C CH
Cíclicos
Saturados Cicloalcanos → Formula molecular general CnH2n
CH2
CH2 − CH2
Insaturados Cicloalquenos → Formula molecular general CnH2n−2
(Solo si el cicloalqueno posee 1 enlace doble)
Aromáticos Formados por el compuesto básico benceno.
Tabla de Hidrocarburos Alifáticos
N° de átomo de carbono
Alcanos CnH2n+2
Nombre AlquenosCnH2n
Nombre AlquinosCnH2n−2
Nombre
1 CH4 Metano – – – –
2 C2H6 Etano C2H4 Eteno C2H2 Etino
3 C3H8 Propano C3H6 Propeno C3H4 Propino
4 C4H10 Butano C4H8 Buteno C4H6 Butino
5 C5H12 Pentano C5H10 Penteno C5H8 Pentino
6 C6H14 Hexano C6H12 Hexeno C6H10 Hexino
7 C7H16 Heptano C7H14 Hepteno C7H12 Heptino
8 C8H18 Octano C8H16 Octeno C8H14 Octino
9 C9H20 Nonano C9H18 Noneno C9H16 Nonino
10 C10H22 Decano C10H20 Deceno C10H18 Decino

Serie Homóloga
Corresponde a la serie de compuestos cuyas cadenas de carbono difieren en el número de unidades de –CH2– (metilenos) con los que se ha incrementado el esqueleto y cuyos miembros tienen funciones químicas similares.
Fórmula Molecular Nombre Fórmula estructural
CH4 METANO H
H
H
H C
C2H6 ETANO H H
H H
HH C C
C3H8 PROPANO H H H
H
HH H
H C C C
C4H10 BUTANO H H H H
H
HHH H
H C C C C
C5H12 PENTANO H H H H
H
H
H
HHH H
H C C C C C
Isomería
Recibe este nombre la propiedad que tienen algunos compuestos que, a pesar de poseer la misma fórmula molecular, presentan propiedades diferentes por tener diferente fórmula estructural.
Hay varias formas de clasificación, las cuales se pueden agrupar en dos categorías: isomería plana o estructural y estereoisomería o isomería espacial.
Tipos de isómeros
a) Estructurales: los átomos se unen en distinto orden.
• De esqueleto: diferentes cadenas carbonatadas. Ej: butano y metilpropano.• De posición: grupo funcional en distinta posición. Ej: 2-pentanol y 3-pentanol.• De función: grupo funcional diferente. Ej: 2-butanol y dietiléter.
b) Espaciales (estereoisómeros): diferente disposición espacial.
• Geométricos (cis-trans): asociada a enlace C=C.• Ópticos (enantiómeros): uno es la imagen especular del otro. Presencia de al menos un
carbono asimétrico (quiral).

Nomenclatura de radicales
Cuando un hidrocarburo pierde un átomo de hidrógeno da lugar a un radical, especie reactiva que se une a otras cadenas carbonadas formando una ramificación.
Se nombran con el sufijo –ilo (o –il).
Radical NombreCH3− Metilo
CH3− CH2− EtiloCH3− CH2− CH2 − Propilo
CH3− CH2− CH2 − CH2 − Butilo
CH3− CH2− CH2 − CH2 − CH2 − Pentilo
Radical NombreCH2= CH − Vinilo (etenilo)
CH2= CH − CH2 − Anilo (2−propelino)CH3− CH −
CH3Isopropilo (2−metiletilo)
CH3− CH − CH2 −
CH3Isobutilo (2−metilpropilo)
CH3− CH2 − CH −
CH3Sec-butilo (1−metilpropilo)
CH3− C −
CH3
CH3
Terc-butilo (1,1−dimetiletilo)

Losgrupos funcionalesmáscomunessonlossiguientes:
Familia Formula empírica Grupo funcionalHalogenurosdealquilo X - R - X
Alcoholes R- OH - OHÉteres R- O- R` - O-
Aminasprimarias R- NH2 - NH2
Aminassecundarias R- NH- R` - NH-
AminasterciariasR- N- R`
R``
- N-
AldehídosR- C= O
H
- C= O
H
Cetonas R- CO- R` - C=O
ÁcidosR- COOH - C= O
OH
ÉsteresR- COO- R` - C= O
O
AmidasR- CON- R` - C= O
- N-
HalogenurosdeácidoR- COX - C= O
X
Nitrilos R- CN - CN
En la naturaleza existen miles de compuestos que tienen, además de carbono e hidrógeno, átomos de nitrógeno, azufre, oxígeno y fósforo, entre otros.
La presencia de estos u otros átomos en la estructura de una molécula, le conieren un conjunto de propiedades, por ejemplo, la forma en que reaccionarán frente a distintos reactivos.

Haluros o halogenuros de alquilo (R–X)
Provienenengeneraldelasustitucióndeunoomáshidrógenosdeunalcanoporhalógenos(F,Cl,Br,I).
Se nombran en general y usando como palabra genérica el halógeno seguido del nombre delhidrocarburocorrespondiente.
CH3Br→Bromometano
CHCl3→Triclorometano
CH3CH2Cl→Cloroetano
Alcoholes(R–OH)
Soncompuestosque resultande lasustitución deátomosdehidrógenode loshidrocarburosporgrupos hidroxilos(OH).
Existenalcoholesprimarios,secundariosyterciarios.
CH3CH(OH)CH3→2-propanol.Alcoholsecundario.
→Alcoholterbutilico.Alcoholterciario.CH3- C- CH3
CH3
OH
CH3OH→Metanol.Alcoholprimario.
Éteres(R–O–R)
Soncompuestos orgánicosqueprovienendelaunióndedosmoléculasdealcoholconeliminacióndeunamoléculadeagua.
CH3–CH2–OH+CH3–CH2–OH→ CH3–CH2–O–CH2–CH3+H2O
Senombransinnumerar lacadena, tomandoencuentaelnombrede los radicales.Engeneralsenombrancomoéteryluegoelnombredelradicaldecadenamáslargaydespuéselnombredelradicalmáspequeñoterminadoenilico.
CH3–O–CH3→éterdimetílico
CH3–O–CH2–CH2–CH2–CH2–CH3→éterpentilmetílico

Aldehídos(R–CHO)
Son compuestos orgánicos que provienen de ladeshidrogenación de los alcoholes primarios, esdecir,porpérdidadedosátomosdeH.
Senombrancambiandoolporal.
CH3- CH2- CHO→propanalCHO- CHO→etanodialCH3- CHO→etanal
Tambiénseconocenaldehídosencompuestosinsaturados.
CH2=CH–CHO→2–propenal
Ésteres(R–COO–R)
Resultandelareaccióndeunalcoholconelácido carboxílicoconeliminacióndeunamoléculadeagua.
R–COOH+ROH→R–COO–R+H2O
Senombrancambiandoelsuijoicoporatoenelradicaldecadenamáslargacontandoelcarbonodelgrupofuncionaléster,seguidodelnombredelsiguienteradicaldecadenamáscorta.
CH3–COO–CH3→etanoatodemetilo
CH3–CH(CH3)–COO–CH2–CH3→2–metilpropanoatodeetilo
Losésteresseidentiicanfácilmenteporquetienenunaromaagradable.Porejemplo,laesenciadelanaranja(acetatodeoctilo).
Aminas(R–NH2)
Soncompuestos orgánicos nitrogenadosqueseforman,engeneral,reemplazandoloshidrógenosdelamoniaco(NH3)poralgúnsustituyentecarbonado.
Aminas primarias:R–NH2(unHessustituido).Aminas secundarias:R–NH–R’(dosHsonsustituidos).Aminas terciarias:R–N(R’)–R’’(tresHsonsustituidos).
SenombranconlaterminaciónaminacuandoesprimariaocomoNalquilaminacuandoessecundariaoterciaria.

Ácidos carboxílicos(R–COOHoR–CO2H)
Soncompuestos orgánicosqueprovienenengeneraldelaoxidacióndeunaldehídoolaoxidaciónenérgicadelosalcoholesprimarios,enpresenciadeunagenteoxidantecomoelKMnO4oK2Cr2O7.
Senombranconlapalabragenéricaácidoylaterminaciónoicoenelradical.
HCOOH→ácidofórmicoCH3COOH→ácidoacéticoCH2=CH–COOH→ácido2-propenoico
Amidas(R–CONH2)
Seobtienenalreemplazarelgrupohidroxilodelácidocarboxílicoporsustituyentesnitrogenados.
Engeneral,sepuedensintetizarapartirdeunácido carboxílicoyunaamina:
RCOOH+NH2R→RCONHR+H2O
Senombranengeneralcolocandoelsuijoamida.
CH3–CONH2→etanamida
CH3CH(CH3)CH2–CONH2→3-metilbutanamida