Y G M P C ELEVINA PÉREZ SIRA NTONIETA … · La fenilcetonuria es un EIM de las proteínas, las...
Transcript of Y G M P C ELEVINA PÉREZ SIRA NTONIETA … · La fenilcetonuria es un EIM de las proteínas, las...
211
TERAPIAS NUTRICIONALES NOVEDOSAS Y OTROS ENFOQUES UTILIZADOS
EN EL TRATAMIENTO DE PACIENTES CON FENILCETONURIA.ARTÍCULO ORIGINAL
YUNIESKY GONZÁLEZ MUÑOZ, CAROLINA PALOMINO CAMARGO,ELEVINA PÉREZ SIRA, ANTONIETA MAHFOUD HAWILOU
Terapias nutricionales novedosas y otros enfoques utilizados en el tratamiento de pacientes
con fenilcetonuria.
Novel Nutritional therapies and other approachesused in the treatment of patients with
Phenylketonuria.
Yuniesky González Muñoz1,a, Carolina Palomino Camargo1,b,Elevina Pérez Sira1,c, Antonieta Mahfoud Hawilou2,d.
Enviar correspondencia a: Lic. Yuniesky González Muñoz. Dirección física: Ave. Suapure, Colinas de Bello Monte, Instituto de Ciencia y Tecnología de Alimentos, Universidad Central deVenezuela, Caracas, Venezuela. Email: [email protected]
1-Instituto de Ciencia y Tecnología de los Alimentos (ICTA), Facultad de Ciencias, Universidad Central de Venezuela (UCV).Caracas-Venezuela.2-Fundación Instituto de Estudios Avanzados (IDEA). Caracas-Venezuela.a-Candidato a Magíster en Ciencia y Tecnología de los Alimentos (ICTA-UCV). Licenciado en Ciencias de los Alimentos,Universidad de la Habana-Cuba.b-Doctorando en Ciencia y Tecnología de Alimentos (ICTA-UCV). Magíster Scientiarum en Ciencia y Tecnología de losAlimentos (ICTA-UCV). Licenciada en Biología-Mención Tecnología de los Alimentos (UCV).c-Dra. en Ciencia y Tecnología de los Alimentos (ICTA-UCV). Master of Science, Major: Food Science and Nutrition, Universityof Wisconsin-Stout US. Licenciada en Biología, Universidad Central de Venezuela (UCV). d-Directora de Salud del Instituto de Estudios Avanzados (IDEA). Investigadora de la Unidad de Estudio de Errores Innatos delMetabolismo (IDEA). Especialista en Pediatría y Neurología Infantil. Médico – Facultad de Medicina de la UCV. Caracas,Venezuela.
RESUMENEl tratamiento dietético tradicional de los pacientes con fenilcetonuria (PKU) ha constituido, desde sus inicios, ungran éxito para la prevención del retraso mental generado por la acumulación de fenilalanina en la sangre. Sinembargo, la dieta baja en fenilalanina representa una carga que muchas veces dificulta su seguimiento y, a suvez, se le atribuye a estos pacientes cierta deficiencia nutricional. Todo ello constituye uno de los motivos por loscuales se hace necesaria la búsqueda de terapias alternativas que mejoren el pronóstico y la calidad de vida delos pacientes con PKU. Se han desarrollado actualmente diversos enfoques novedosos, tanto desde el punto devista nutricional como no nutricional. Un ejemplo de ello lo constituye la suplementación de la dieta con amino-ácidos neutros grandes y la utilización de glicomacropéptidos en el desarrollo de alimentos nutricionalmentecompletos, por el rol que desempeñan en el restablecimiento de los niveles de fenilalanina. Asimismo, la imple-mentación de ácidos grasos polinsaturados de cadena larga tiene un papel importante en el desarrollo neuroló-gico de los pacientes. Adicionalmente, se han desarrollado terapias encaminadas a aumentar o suplantar la acti-vidad de la fenilalanina hidroxilasa, como es el caso de la administración de tetrabiopterina o fenilalanina amo-nioliasa que representan, para algunos pacientes, una solución alejada de una dieta estricta. Además, investiga-ciones preclínicas de terapias génicas y celulares para PKU están en curso. El presente trabajo tiene la finalidadde revisar el conocimiento actual sobre las terapias nutricionales novedosas y otros enfoques utilizados en el tra-tamiento de pacientes con PKU.Palabras Clave: Fenilcetonuria, terapias nutricionales novedosas, tratamientos farmacológicos novedosos.
212
ACTUALIZACIÓN EN NUTRICIÓN VOL 14 - Nº 3 - SEPTIEMBRE 2013 NUTRICIÓN CLÍNICA
Novel Nutritional therapies andother approaches used in thetreatment of patients with
Phenylketonuria.
SUMMARY
The traditional dietary treatment of Phenylketonuria(PKU) has resulted in great success in the prevention ofmental retardation caused by the accumulation ofPhenylalanine in the blood. However, patients often findit difficult to follow the low-Phenylalanine diet, whichstill carries risk of associated nutritional deficiencies. Thisis one of the reasons why it is necessary to seek alternativetherapies that improve the prognosis and quality of lifeof PKU patients. Several new approaches have recentlybeen developed, both from a dietary and no-dietarypoint of view. An example of these is the dietary supplementationof large neutral amino acids and the use of glycomacropeptidein the production of nutritionally complete foods, becauseof the role they play in the restoration of Phenylalaninelevels. Furthermore, the introduction of long-chainpolyunsaturated fatty acids plays an important role inthe patients’ neurological development. Further therapieshave been developed that increase or replace the activityof Phenylalanine hydroxylase, such as the administration ofPhenylalanine ammonia-lyase or tetrabiopterin, whichmay offer some patients a solution to a strict diet. Inaddition, preclinical research of gene and cell-basedtherapies for the treatment of PKU are underway. Theaim of this paper is to review current knowledge aboutnew nutritional therapies and other new approachesused in the treatment of PKU patients.Keywords: Phenylketonuria, new nutritional therapies,new drug therapies
Terapias nutricionais inovadoras eoutros enfoques utilizados no tratamento de pacientes com
fenilcetonúria
RESUMO
O tratamento dietético tradicional dos pacientes comfenilcetonúria (PKU) tem constituído, desde o seu começo,um grande sucesso para a prevenção do atraso mentalgerado pela acumulação de fenilalanina no sangue. Noentanto, a dieta baixa em fenilalamina representa umacarga que muias vezes dificulta o seu acompanhamento,e por sua vez, atribui-se a estes pacientes certa deficiêncianutricional. Tudo isto constitui um dos motivos pelosquais se faz necessária a busca de terapias alternativasque melhorem o prognóstico e a qualidade de vida dospacientes com PKU. Foram desenvolvidos atualmentediversos enfoques inovadores, tanto a partir do ponto devista nutricional quanto não nutricional. Um exemplodisso é suplementação da dieta com aminoácidos neurograndes e a utilização de glimacropéptidos no desenvolvimentode alimentos nutricionalmente completos, pela funçãoque desempanham no restabelecimento dos níveis defenilalanina. Além disso, a implementação de ácidos graxospolinsaturados de cadeia longa tem um papel importanteno desenvolvimento neurológico dos pacientes.Adicionalmente, foram desenvolvidas terapias encaminhadaspara aumentar ou substituit a atividade da fenilalaninahidroxilase, como é o caso da administração de tetrabiopterinaou fenilalanina amonioliasa que representam, paraalguns pacientes, uma solução distante de uma dietaestrita. Além disso, pesquisas pré-clínicas de terapiasgênicas e celulares para PKU estão em curso. O presentetrabalho tem a finalidade de revisar o conhecimentoatual sobre as terapias nutricionais inovadoras e outrosenfoques utilizados no tratamento de pacientes com PKU.Palavras-chave: Fenilcetonúria, terapias nutricionaisinovadoras, tratamentos farmacológicos inovadores
English Português
1. INTRODUCCIÓNLos Errores Innatos del Metabolismo (EIM) incluyen tras-tornos bioquímicos hereditarios, en los cuales un defec-to en una enzima específica interfiere con el metabolis-mo normal de las proteínas, grasas, o de los carbohidra-tos. Como resultado de la ausencia o disminución de laactividad enzimática, ciertos componentes se acumu-lan en el cuerpo alcanzando niveles tóxicos que, de noser tratados, pueden conducir al desarrollo de conse-cuencias que oscilan entre el deterioro intelectual adaños cognitivos diversos e incluso la muerte. Mediantela identificación temprana y la iniciación del tratamien-
to, muchos de estos errores pueden ser mitigados o pre-venidos. Para numerosos EIM la estrategia del trata-miento subyace en la provisión de alimentos médicosespecializados y suplementos dietarios.1-4
La fenilcetonuria es un EIM de las proteínas, las cualesestán compuestas de diversos aminoácidos, y uno deellos es la fenilalanina (Phe, por sus siglas en ingles).Este aminoácido es un nutriente esencial utilizado porel organismo para formar las proteínas de los múscu-los, neurotransmisores, hormonas, enzimas digestivas,anticuerpos, etcétera. Por consiguiente, es importante
213
que el organismo tenga una cierta cantidad de Phe,aunque es significativo que no exista un exceso deeste aminoácido.5,6
La nutrición juega un papel importante en el manejode los EIM1,7,8. En el caso específico de la fenilcetonuria(PKU, por sus siglas en ingles), el principal tratamientoque se ha llevado a cabo, por años, está basado en laintroducción de una dieta baja en fenilalanina.5,9 Estadieta, que tiene el fin de mantener niveles de Phe enlímites seguros, se inicia en el periodo neonatalmediante el suministro de fórmulas especiales sin Pheo una mezcla de aminoácidos, que aporten las necesi-dades requeridas de proteínas y energía.1,5 Sin embar-go, para los pacientes con PKU, en la mayoría de loscasos, los productos desarrollados no son lo apropia-damente palatables. Esto constituye una de las tantasrazones por las cuales se buscan nuevos sustitutosproteicos bajos en fenilalanina.1,10 Adicionalmente, elhecho de disponer de tratamientos que permitan eluso de una dieta sin restricciones en Phe o que, almenos, se aproxime a la dieta generalmente utilizadapor las personas libres de PKU, representa una solu-ción ideal en estos pacientes.10,11 Por ello, investigarsobre las nuevas alternativas al tratamiento dietario ymejorar la composición y presentación de los produc-tos dietéticos ha sido el objetivo de diversas investiga-ciones en los últimos años.10-12 En este sentido, el pre-sente trabajo tiene el propósito de presentar informa-ción actualizada sobre las diversas terapias nutriciona-les y no nutricionales utilizadas en el tratamiento delos pacientes PKU.
2. GENERALIDADES DE LA FENILCETONURIA (PKU)2.1. Descubrimiento de la PKUEn la primavera de 1934, la señora Borgny Egeland,madre de dos hijos de 4 y 6 ½ años, muy preocupadapor el retraso mental que ambos presentaban, asocia-do a un intenso olor peculiar, había consultado endiversas instituciones sin obtener la ayuda o soluciónesperada. El padre (Harry Egeland) era dentista y pade-cía de asma grave; no podía entrar en la habitación delos niños debido a que el fuerte olor le provocaba unareacción asmática. Le sugirieron que se pusiera encontacto con el Dr. Ivar Asbjørn Følling (FisiólogoNoruego, 1888–1973), profesor de InvestigacionesNutricionales de la Escuela de Medicina (Universidadde Oslo, Noruega).13,14
El propio Følling ha recogido por escrito sus recuerdosde la visita de esta madre con sus dos hijos: "No teníaesperanza alguna de poder ayudarle realmente, y exa-miné a los niños principalmente porque no quería serhostil hacia la madre. En la exploración clínica de lospacientes no encontré signos significativos salvo que,ambos tenían un retraso mental. Los análisis ordinariosde orina fueron normales, pero tras añadir cloruro
férrico a la orina, en busca de cetonas, apareció unacoloración verdosa, que desapareció minutos des-pués. Nunca había visto una reacción de ese tipo ytampoco estaba descrita en la literatura. La orina reco-gida unos días más tarde, tras retirar toda la medica-ción que recibían, se comportaba de manera similar.Probablemente había una sustancia desconocida en laorina, y el problema principal me pareció que era ais-lar e identificar esta sustancia”. Decididos a resolver elmisterio, Folling solicitó a la madre que le proporcio-nara muestras de orina cada dos días durante un perí-odo de dos meses. Folling trabajó diligentementedurante dos mes y medio para aislar la sustancia res-ponsable de la reacción química extraña en la orina.13,14
“El método que se mostró eficaz fue el siguiente: laorina era saturada con cloruro sódico, acidificada conácido clorhídrico, seguida de una extracción con éter.A continuación, extracción con carbonato sódico, aci-dificación y re-extracción con éter. Ahora la sustanciapodía ser recristalizada a partir de una mezcla de clo-roformo/benceno. Durante las extracciones, la pruebadel cloruro férrico indicaba la presencia de la substan-cia. Después de esta purificación comenzó la identifi-cación de la estructura química de la sustancia... quesugería una estructura de un anillo bencénico con unacadena lateral de tres átomos de carbono. La configu-ración más probable era la del ácido fenilpirúvico. Lasustancia se mezcló con ácido fenilpirúvico de síntesis,lo que no alteró el punto de fusión, probando portanto la identidad de la sustancia.” Fölling la denomi-nó “Imbecillitas Phenylpyruvica”, también conocidacomo enfermedad de Fölling, que cursaba con ungrave daño cerebral, en la que estaba implicada unasustancia que se originaba como producto del meta-bolismo de las proteínas, denominada Fenilalanina.13,14
En su escrito, continúa el Dr. Asbjørn Følling,“Aparentemente, existía la posibilidad de una asocia-ción entre el retraso mental y la excreción de ácidofenilpirúvico. Por esto busqué casos similares. Entre430 niños internados en instituciones para retrasadosmentales en Oslo, se encontraron ocho enfermos máscon la misma reacción al cloruro férrico. Los dos rasgosdistintivos fundamentales eran el retraso mental y laexcreción de ácido fenilpirúvico en la orina”.13-15
Tres años más tarde, en 1937, Penrose y Quastel16 sugirie-ron que se denomine a esta enfermedad Fenilcetonuria,nombre con el que se le conoce hoy en día. En el año1944, Bernheim demostró que la principal vía catabólicade la Fenilalanina es la transformación por parahidroxila-ción en Tirosina.13
En 1947, Jervis17 observó que cuando se administrabafenilalanina a individuos sanos, en éstos se producíaun aumento de otra sustancia denominada tirosina.Pero cuando administraba fenilalanina a individuoscon Fenilcetonuria, no presentaban tal elevación. Tras
TERAPIAS NUTRICIONALES NOVEDOSAS Y OTROS ENFOQUES UTILIZADOS
EN EL TRATAMIENTO DE PACIENTES CON FENILCETONURIA.ARTÍCULO ORIGINAL
YUNIESKY GONZÁLEZ MUÑOZ, CAROLINA PALOMINO CAMARGO,ELEVINA PÉREZ SIRA, ANTONIETA MAHFOUD HAWILOU
214
ACTUALIZACIÓN EN NUTRICIÓN VOL 14 - Nº 3 - SEPTIEMBRE 2013 NUTRICIÓN CLÍNICA
varios años de investigación, Jervis concluyó finalmenteque en la enfermedad, conocida como Fenilcetonuria,se producía una falta en la transformación de fenilalani-na a tirosina. Los avances en el tratamiento de la enfer-medad no se iniciaron hasta 1953, cuando Bickel(Médico Alemán 1918–2000), publicó sus primeros tra-bajos, en los que demostraba la efectividad de una dietaespecial restringida en fenilalanina.13
En 1961, Guthrie creó el método de inhibición bacteriana,para medir la fenilalanina en sangre. Entre 1957 y 1963Kaufman y su grupo, demostraron la complejidad del siste-ma Fenilalaninhidroxilasa, en el que están implicadosvarios sistemas enzimáticos y cofactores, de los que losprincipales componentes son la BH4 (tetrahidrobiopterina)y la DHPR (dihidropteridin reductasa), y que estos compo-nentes forman parte de otros sistemas de hidroxilación.13
Finalmente, en 1983, los doctores Li Chen y Savio L. C.Woo, ambos del Departamento de Medicina Celular yGenética (Escuela de Medicina Mount Sinai), aislaron eidentificaron por primera vez el gen donde se dan lasinstrucciones para la síntesis de la enzima fenilalaninahidroxilasa, cuya deficiencia es la responsable, principal-mente, de la enfermedad.13
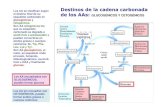
2.2. Definición La PKU es un error congénito del metabolismo, que sehereda con carácter autosómico recesivo, causado por ladeficiencia de fenilalanina hidroxilasa (FAH), la cual con-vierte la Phe dietaria (aminoácido esencial: aa.e.) a tirosi-na (aminoácido no esencial). La ausencia de esta enzimacausa acumulación plasmática y tisular de fenilalanina,que tiene efecto tóxico. El exceso de este aminoácido, seconvierte por acción de una transaminasa en ácido fenil-pirúvico que es eliminado por la orina. Esta alteraciónlesiona el Sistema Nervioso Central, originando un gravetrastorno del desarrollo mental en niños afectados,dejando graves secuelas neurológicas y diferentes gradosde discapacidad mental (retraso mental, convulsiones,comportamiento similar al autismo) si no es detectada atiempo, y una menor producción de melanina, lo quegenera una ausencia relativa del pigmento en piel, ojos ycabello. Además, es característico de este fenotipo el olorpeculiar causado por la elevada concentración de fenila-mina en plasma y/o sus metabolitos principales (fenilpi-ruvato, fenillactato y fenilacetato de metilo)9,15,18-21 (figura 1).El mecanismo exacto sobre el daño neurológico permane-ce sin aclararse, aunque se han sugerido una pobre mielini-
215
zación durante el desarrollo del sistema nervioso central ytrastornos en la producción de neurotransmisores.22
La hiperfenilalaninemia (HFA) también puede ser causa-da por la deficiencia de Tetrahidrobiopterina (BH4), coen-zima de la fenilalanina hidroxilasa, la tirosina-3-hidroxila-sa y la triptófano-5-hidroxilasa, estas dos últimas enzimasson necesarias para la síntesis de neurotransmisoresL-Dopa y Serotonina.11,18-20
Es necesario aclarar además, que la HFA ocurre en másdel 98% de los casos por mutaciones en el gen que codi-fica la L-fenilalanina hidroxilasa; 1 a 2% se debe a defectosen otras enzimas involucradas en la síntesis o regenera-ción de la BH4. Las enzimas involucradas en la síntesis deBH4 son la GTP-ciclohidrolasa I (GTPCH), la 6-piruvoilte-trahidropterina sintetasa (PTPS), y la sepiapterina reduc-tasa (SR); y las enzimas para su regeneración: dihidropte-ridina reductasa (DHPR) y la pterin-4-α-carbinolaminade-hidratasa (PCD) (figura 1 y tabla 1).23
La fenilcetonuria tiene una incidencia en los E.U.A deentre 1:10.000 a 1:15.000 nacidos en aquellos descen-dientes europeos, asiáticos y amerindios, aunque sepuede diagnosticar en otros grupos étnicos y raciales.Existe un estimado de alrededor de 50.000 individuoscon PKU tratados en todo el mundo.21,22 En Chile se hadeterminado una incidencia de 1:14.000 recién nacidosvivos, en Japón es 1:10.000 y en Venezuela, a través delPrograma de Pesquisa Neonatal realizado desde 1985 enel Instituto de Estudios Avanzados, se han analizado506.385 neonatos, encontrando una incidencia de1:27.989 nacidos vivos.24,25
2.3. Categorías de la PKULuego de efectuar una búsqueda sobre la terminología
relacionada con la clasificación PKU se pudo observarque existían ciertas diferencias en cuanto a los términos ycriterios manejados para efectuar su clasificación. Ramírez et al. (2007)23 en el trabajo titulado: “Controversiasen la clasificación de las hiperfenilalanemias. Propuesta deUnificación” también plantean que existe una gran dispa-ridad en la nomenclatura de esta enfermedad, por ejem-plo, HFA, HFA benigna, HFA persistente, atípica, media ymoderada, HFA forma no-PKU, PKU moderada, PKU leve,PKU clásica, entre otras denominaciones. Estos investiga-dores encontraron 28 clasificaciones para HFA y 23 paraPKU. El criterio principal para clasificar esta enfermedadfue la concentración sanguínea basal de Phe; sin embar-go, no hubo un criterio unificado para las unidades en lasque se expresa la concentración de dicho aminoácido.Por otro lado, diversos autores utilizan miligramos pordecilitro (mg/dL) y otros micromoles por litro (μmol/L) omicromolar (μM). Después de la Phe, el nivel sérico detirosina (Tyr) y su cociente, son los criterios más frecuen-temente utilizados para tipificar la enfermedad; sinembargo, también existen diferencias en los valores nor-males del cociente Phe/Tyr, pues algunos autores consi-deran patológico un cociente de 1,5 y otros hasta de 3,0.Diversos investigadores también incluyen como criteriola tolerancia dietética a la Phe, cuantificada mediante unaprueba específica de reto. Prácticamente en todos losartículos, se estudian las biopterinas para asegurar que laHFA se debe a defectos en la FAH y no a otras enzimas dela misma ruta metabólica.Basándose en lo planteado anteriormente por Ramírez etal. (2007)23, los mismos proponen una clasificación de lostrastornos de la fenilalanina por defecto de la FAH comose cita a continuación (Tabla 2):
TERAPIAS NUTRICIONALES NOVEDOSAS Y OTROS ENFOQUES UTILIZADOS
EN EL TRATAMIENTO DE PACIENTES CON FENILCETONURIA.ARTÍCULO ORIGINAL
YUNIESKY GONZÁLEZ MUÑOZ, CAROLINA PALOMINO CAMARGO,ELEVINA PÉREZ SIRA, ANTONIETA MAHFOUD HAWILOU
216
ACTUALIZACIÓN EN NUTRICIÓN VOL 14 - Nº 3 - SEPTIEMBRE 2013 NUTRICIÓN CLÍNICA
HFA benigna: Pacientes con niveles séricos de Pheentre 2-4mg/dL (120-240µM) sin restricción dietética,es decir, que toman leche materna, sucedáneo o desoya. Debe hacerse una segunda prueba y si es<4mg/dL (240µM) 2 horas después del alimento, lospacientes deben ser monitoreados. Si se eleva la feni-lalanina, se iniciará tratamiento dietético congruentecon la edad, el peso y la tolerancia.Es importante recordar que la HFA materna durante elembarazo puede ser causa de cardiopatías y otrasmalformaciones. Por lo tanto, toda paciente con HFAque desee embarazarse debe medir sus niveles de Phey controlarse antes de iniciar el embarazo. Si seencuentran elevados se debe dar tratamiento nutri-cional durante la gestación.HFA leve, clínicamente significativa: Los pacientescuyas concentraciones de Phe se encuentran entre 4-10mg/dL (240-600µM), requieren restricción de Phe,suplemento de Tyr y fórmula nutricional especial enforma permanente. Sin embargo, toleran mayor canti-dad de Phe por kg de peso e inclusive, dependiendode su evolución, podrán llegar a incluir algunos ali-mentos de origen animal en su dieta.PKU moderada: Pacientes con Phe entre 10-16,6mg/dL (600-1.000µM). Requieren restricciónestricta de Phe, suplemento de Tyr y fórmula nutricio-nal especial. Deben ser vigilados igual que los pacien-tes con HFA leve o clínicamente significativa.PKU clásica: Niños cuyas concentraciones de Phe son>16,6mg/dL (1.000µM), con baja tolerancia a la Phe.Debe medirse su concentración sérica con la mismafrecuencia que los pacientes con HFA leve, clínicamen-te significativa. Si están enfermos o si se sospecha quetienen elevaciones de Phe, se les debe vigilar con lafrecuencia necesaria. Afortunadamente, en la actualidad existen nuevaspruebas bioquímicas para diferenciar a los enfermosde HFA, como las curvas de tolerancia a la Phe dietéti-ca, la respuesta a la BH4, y la biología molecular. Elobjetivo terapéutico es mantener a todos los pacien-tes con HFA o PKU en niveles séricos de Phe <4mg/dL(240μM) hasta los10 años de edad.23
En cuanto a esta clasificación, otros autores (Cueto D,201124; Feillet et al., 201026; Pereda et al., 200815)manejan un límite de 20mg/dL de Phe, entre la PKUmoderada y PKU clásica. Lo mismo ocurre para el lími-te entre HFA benigna y HFA clínicamente significativadonde otros especialistas en el área como Belmont etal., (2012)27 establecen el valor de 6 mg/dL (Tabla 2). Apesar de estas discrepancias, la gran mayoría concuer-da en que las concentraciones de fenilalanina en lasangre deben permanecer muy próximas o por deba-jo de los valores normales con la finalidad de evitarponer en riesgo al paciente.
2.4. Diagnóstico y control de la PKUSe ha demostrado ampliamente que el diagnósticoneonatal, la instauración precoz del tratamiento nutri-cional y la vigilancia estricta, permite que los niñosPKU tengan crecimiento y desarrollo normal.5 El diag-nóstico de la enfermedad debe ser precoz, por lo quees necesario realizar un tamiz neonatal entre las 48h ylos 10 primeros días posteriores al nacimiento, queconsiste en identificar a los pacientes (recién nacidosaparentemente sanos) mediante la cuantificación san-guínea de fenilalanina. Para ello es suficiente unapequeña muestra de sangre del bebé (obtenida al pin-char el talón); posteriormente las gotas de sangrecapilar se impregnan en un papel de filtro específico(tarjeta de Guthrie).28 El test de cribado, a través de latécnica de fluorometría, tiene una sensibilidad y unaespecificidad cercanas al 99%. Para un diagnósticodefinitivo y más específico de la enfermedad, serequiere un análisis cuantitativo de la concentraciónde Phe y de Tyr en la sangre, usualmente determinadopor cromatografía líquida de alta resolución (HPLC),espectrometría de masas en tándem (MS/MS) oambos métodos (figura 2).15,27,29
En los programas de Tamizado Neonatal PKU, los valo-res de corte para distinguir entre sanos y enfermosvarían dependiendo del método analítico empleado;el criterio más unificado es un valor de Phe >2mg/dL(>120μmol/L); por lo tanto todo neonato cuya Phe seencuentre en dicho valor, debe ser considerado comocaso probable de PKU y sometido a estudios que con-firmen o descarten la enfermedad. Este es el patrón detodas las formas de hiperfelinalanemia/fenilcetonuria.Si los niveles de Phe son >120μM, la concentraciónsérica de Tyr es normal o <118μM, con concentracio-nes normales de los aminoácidos restantes, y la rela-ción Phe/Tyr es >2, se confirma el diagnóstico de HFA(figura 3).27,30
En estos pacientes deben realizarse dos evaluacionesdiagnósticas. En primer lugar, debe aclararse si elpaciente tiene un defecto en la síntesis o reciclaje deBH4 (figura 4). En segundo lugar, si no tiene tales
217
TERAPIAS NUTRICIONALES NOVEDOSAS Y OTROS ENFOQUES UTILIZADOS
EN EL TRATAMIENTO DE PACIENTES CON FENILCETONURIA.ARTÍCULO ORIGINAL
YUNIESKY GONZÁLEZ MUÑOZ, CAROLINA PALOMINO CAMARGO,ELEVINA PÉREZ SIRA, ANTONIETA MAHFOUD HAWILOU
218
ACTUALIZACIÓN EN NUTRICIÓN VOL 14 - Nº 3 - SEPTIEMBRE 2013 NUTRICIÓN CLÍNICA
defectos, se debe evaluar si el paciente con hiperfeni-lalaninemia/fenilcetonuria se puede tratar solo conrestricciones en la dieta, o puede ser ayudado en partesolo con BH4 o con la combinación de este y una dietarestringida.30
En los países europeos, según Van Rijn (2007)31, el niñoes tratado en el hospital y se le da una carga de BH4(20mg/kg de peso corporal por vía oral). Su concentra-ción de fenilalanina sanguínea se mide antes, a las 8,16, y 24h después de suministrada la carga de BH4. Lanormalización destacada (dentro de las 8h) en las con-centraciones de fenilalanina indican deficiencia deBH4, mientras que muy poca o ninguna reducción enfenilalanina demuestra que la fenilcetonuria no res-ponde al BH4.12,30 En los EE.UU. no se suministra BH4 alos bebés recién nacidos. En su lugar, muestras de san-gre secas en papel de filtro y orina se obtienen para lasmediciones de pterinas urinarias (neopterina y biopte-rina) y dihidropteridina reductasa en glóbulos rojospara evaluar la posibilidad de un defecto asociado condeficiencia de BH4. Los siguientes patrones anormalesde pterina en sangre u orina son diagnósticos para losdiferentes tipos de deficiencia de BH4: en la deficien-cia de GTP-ciclohidrolasa-I ambas neopterina y biopte-rina son muy bajas o no detectables; en la deficienciade la 6-piruvoiltetrahidropterina sintetasa (PTPS), laneopterina es muy alta y la biopterina es muy baja ono detectable; en la deficiencia de la pterin-4-α-carbi-nolaminadehidratasa (PCD), la neopterina es alta, labiopterina es baja o marginal, y la primapterina es alta;y en la deficiencia de la dihidropteridina reductasa(DHPR), la actividad de la dihidropteridina reductasa(DHPR) es baja, la neopterina es normal, y biopterinaes alta (figura 4).La prueba de carga de BH4 también puede identificarla sensibilidad de la fenilcetonuria al BH4. Varias prue-bas de carga se han propuesto para el diagnóstico dela sensibilidad a la BH4 después del período neonatal.Estas pruebas usualmente implican una sola dosis o endosis repetidas, con o sin suministro de fenilalaninaconcomitante.12,30,32-34
La definición ampliamente citada de la respuesta alBH4 es una reducción de la Phe en sangre de al menos30%, pero diferentes metas pueden fijarse parapacientes individuales y no se han establecido valoresde corte consensuados para la prueba de carga (figura4). Existen diferentes políticas para las pruebas de sen-sibilidad al BH4 entre Europa y los EE.UU. En Europa,las pruebas que se efectuaban a las 24h se extendie-ron a los 3 días en el 2008. La prueba consiste en unseguimiento de Phe en el primer día; reto con BH4(dosis: 20mg/kg/día) y medición de las concentracio-nes de Phe en sangre antes, a las 8, 16, y 24h despuésdel suministro de la BH4 en el segundo día, más unsegundo reto con la misma dosis de BH4 y el mismo
régimen de muestreo sanguíneo en el tercer día. Unareducción de las concentraciones de fenilalanina ensangre >85% es indicativa de deficiencia de BH4,mientras que una reducción <20% significa que elpaciente no responde (no sensible). Si se observa unarespuesta satisfactoria del tratamiento (concentracio-nes de Phe en sangre reducidas en < 30%), la dosis seajusta (rango recomendado 5-20mg/kg) de acuerdocon la respuesta obtenida. Si no se nota una respuestaadecuada (Phe sanguínea reducida en un 20-30%), eltratamiento a una dosis de 20 mg/kg/día se continúapor 1-3 semanas más, con monitoreo diario de la fenila-lanina en sangre, momento en el que el paciente esdeclarado ser sensible o no sensible (suspender el trata-miento). En pacientes con deficiencia de BH4, las con-centraciones de fenilalanina sanguínea retornan a sunormalidad después de 4-8 horas de suministrado elBH4. En los EE.UU., la BH4 se administra diariamente, ylos pacientes proporcionan muestras de sangre en elhogar en el día 1, 7, y 14. Si es necesario, el BH4 se dadurante 2 semanas más y las concentraciones de Phe ensangre se controlan una vez por semana (figura 4).12,30
Es muy importante hacer el diagnóstico diferencial deltipo de HFA (de ello depende el tipo de tratamientocorrecto). Un paciente con PKU se considera controla-do si la Phe se encuentra entre 120-360μmol/L. Sinembargo, existe controversia para definir cuáles sonlos niveles de Phe deseables (Tabla 3). En Europa losniveles óptimos de control van de 42 a 400μmol/L parapacientes de 1-3 años de edad; en España, hasta480μmol/L en niños de 4-16 años y en algunos centrosmédicos de Alemania, de 42 a 1.200μmol/L en pacien-tes >16 años. En EE.UU. (Hellekson K, 2001)35 los nive-les óptimos para pacientes de 1-12 años de edad sonde 2-6mg/dL (120-360μmol/L) y en los >12 años, 2-15mg/dL (120-900μmol/L). Sin embargo, autores,como es el caso de Bermont et al., (2012)27 establecenconcentraciones terapéuticas de Phe para el primeraño de vida de 360μmol/L con un control bioquímicosemanal, desde el año de edad hasta la adolescencia600μmol/L (con diferencias en la frecuencia del con-trol: mensual, hasta el final de la niñez, y semanal en laadolescencia) y en los adultos 900μmol/L, mensual.Pereda et al., (2008)15 hace mención a niveles de 120-300μmol/L desde el año de vida hasta fin de la niñez,<900μmol/L y 1.200μmol/L en la adolescencia y adul-tez respectivamente, sin establecer frecuencia del con-trol bioquímico.Un aspecto importante en la actualidad es determinarlos niveles óptimos de control para mujeres en edadreproductiva (antes y durante el embarazo). Paísescomo Alemania y Reino Unido señalan de 1-4mg/dL(60-240mmol/L).27 Sin embargo, en la tabla 3 se mues-tran otras consideraciones según varios autores.Independientemente de las recomendaciones existen-
219
tes en los diferentes países, lo más importante es evi-tar valores altos de Phe, y tener presente que unpaciente con valores por debajo de lo normal, tambiénes indicio de descontrol nutricio. En la práctica cotidia-na es difícil lograr que los pacientes siempre estén enniveles óptimos y a medida que crecen, suele disminuir elapego al tratamiento, lo cual constituye un gran reto.27
2.5. Novedosas terapias nutricionalesConcentraciones constantes de Phe en sangre pordebajo de los límites de riesgo puede lograrse con laintroducción de una dieta pobre en este aminoácido.9
Esta dieta específica tiene la finalidad de proporcionartodos los nutrientes esenciales en cantidades adecua-das para promover el óptimo desarrollo físico y mentaly, a su vez, suplir la cantidad óptima del nutriente quees restringido, mientras se prevé o se corrige el desba-lance metabólico.7,36
La dieta clásica PKU provee cantidades mínimas deproductos de origen animal dirigidas a garantizar lacantidad de Phe necesaria en el proceso de crecimien-to y está principalmente basada en hortalizas y frutas(pobres o libres en Phe) y productos sintéticos libresde Phe que suministran aminoácidos esenciales enproporciones adecuadas.5 Sin embargo, la poca acep-tación de las propiedades organolépticas (sabor, olor)de la dieta comercial baja en fenilalanina, afecta sucabal cumplimiento. Además, estos productos produ-cen una baja saciedad y en muchos casos, si no se rea-liza un control y seguimiento nutricional del paciente,se puede generar un desequilibrio nutricional, afec-tando su salud. Por esta razón, la búsqueda constantede nuevas alternativas (nutricionales y no nutriciona-les) representa una meta en constante desarrollo.7,9,36
2.5.1 - Terapia con Aminoácidos neutros grandesEntre las estrategias para el tratamiento PKU seencuentra la suplementación dietética de aminoáci-dos neutrales grandes (LNAA, por su siglas en ingles),con o sin la dieta tradicional.9,10,22,26,30,37 Además de la
Phe, los LNAAs incluyen tirosina, triptófano, treonina,metionina, valina, isoleucina, leucina e histidina. Enindividuos sanos, todos ellos excepto la tirosina, sonaminoácidos esenciales. Particularmente en pacientesPKU, la tirosina se ha convertido en un aminoácidoesencial.10,22,37
En este tratamiento, el mecanismo sugerido se basa enla competencia de la fenilalanina con otros LNAA porproteínas transportadoras específicas que trasladanlos LNAA a través de la mucosa intestinal a la sangre yde la barrera hematoencefálica a la corteza cerebral. Laproteína transportadora responsable del traslado deestos aminoácidos en el cerebro se caracteriza por sualta afinidad por la Phe. Esto, en combinación con altasconcentraciones plasmáticas de Phe, respecto de otrosaminoácidos presentes en una PKU pobremente con-trolada, permite un transporte excesivo de fenilalaninaal cerebro.22
El tratamiento con LNAA como alternativa a la restric-ción dietética de fenilalanina fue sugerido desde 1953.A partir de entonces, diferentes combinaciones deLNAAs han sido diseñadas en base a diversas razones yobjetivos del tratamiento. En forma reciente, el uso deLNAAs como tratamiento alternativo en PKU ha sidorevisado. Los suplementos de LNAA pueden tenermúltiples objetivos tales como: reducción específicade las concentraciones de Phe cerebrales, reducciónen la sangre de las concentraciones de Phe, aumentoen las concentraciones de neurotransmisores cerebra-les, y un incremento de las concentraciones de amino-ácidos esenciales en el cerebro.10,22,37 EspecíficamentePietz et al. (1999)38 confirmaron en sus estudios que losLNAAs bloquean el transporte de fenilalanina al cere-bro, al suministrar un “reto de fenilalanina” con y sinLNAA y midiendo la afluencia de fenilalanina al cerebro. El uso de la terapia de LNAA ha demostrado mejorarlos perfiles de aminoácidos, así como aumentar lasconcentraciones de tirosina y triptófano en la san-gre9,10, y producir un efecto beneficioso sobre el funcio-namiento ejecutivo.10
TERAPIAS NUTRICIONALES NOVEDOSAS Y OTROS ENFOQUES UTILIZADOS
EN EL TRATAMIENTO DE PACIENTES CON FENILCETONURIA.ARTÍCULO ORIGINAL
YUNIESKY GONZÁLEZ MUÑOZ, CAROLINA PALOMINO CAMARGO,ELEVINA PÉREZ SIRA, ANTONIETA MAHFOUD HAWILOU
220
ACTUALIZACIÓN EN NUTRICIÓN VOL 14 - Nº 3 - SEPTIEMBRE 2013 NUTRICIÓN CLÍNICA
En un estudio doble ciego de corto plazo, controladocon placebo, desarrollado por Matalon et. al (2007)39, lautilización de LNAAs en pacientes PKU logró una dis-minución de la fenilalanina en la sangre en un prome-dio del 39% respecto del valor basal.10 Sin embargo, enotro trabajo realizado por Matalon et. al (2006)40, seevidenció una disminución de la fenilalanina en la san-gre en un 55%, efecto relacionado con la dosis utiliza-da de LNAA.37
Vale destacar que la suplementación con LNAA no esun sustituto del alimento médico y de la dieta baja enfenilalanina. Sin embargo, para las personas que tie-nen dificultades para cumplir con la dieta y muestranelevadas concentraciones de Phe en el plasma, losLNAAs pueden ofrecer una opción rentable en lamejora del control metabólico de la PKU.22
Todo lo planteado propone al tratamiento de LNAAcomo una alternativa a la terapéutica convencional dela dieta PKU. Este abordaje alternativo puede aludirpor lo menos a dos estrategias diferentes, es decir, laingesta de proteína natural con el permiso dietéticorecomendado más la suplementación de LNAA, y laterapia convencional (libre de Phe) combinada con lasuplementación dietética de LNAA. Además, el trata-miento con LNAA puede referirse a la suplementaciónde aminoácidos individuales, tales como tirosina, triptó-fano y treonina. Asimismo, es preciso resaltar que senecesitan más estudios que investiguen el papel poten-cial, la dosis y la composición de LNAA en el tratamien-to PKU, así como mostrar su eficacia en el largo plazo.10
2.5.2- Glicomacropeptidos: un nuevo enfoque dietético necesario en PKUAunque ha sido reconocida la implementación de unadieta PKU (basada en aminoácidos) desde el nacimien-to, actualmente es evidente el desprendimiento de lospacientes de las dietas bajas en Phe. Estas dietas pro-ducen en la mayoría de los casos, al ser utilizadas comoúnico tratamiento, un crecimiento y resultados nutricio-nales sub-óptimos.22,42 Por ello, es necesario desarrollarnuevos enfoques para el manejo en la dieta PKU. Las dietas ideales bajas en fenilalanina serían aquellasque contengan, al menos, una fuente libre de fenilala-nina o una proteína intacta baja en fenilalanina, queconstituya una fuente completa en aminoácidos esen-ciales, y en la que las proteínas posean propiedadesfuncionales adecuadas para fabricar una gran variedadde alimentos, que muestren a su vez, poseer propieda-des sensoriales aceptables (sabor, textura y olor).22,42
Una alternativa, apoyada por la investigación en elcorto plazo en pacientes PKU, son los glicomacropep-tidos (GMP), péptido de 64 aminoácidos glicosiladosque contiene un mínimo de fenilalanina. A partir de losGMP se pueden elaborar alimentos nutricionalmentecompletos, aceptables y bajos en fenilalanina para las
personas PKU.22,26,43-46
En comparación con la proteína ideal para la dietaPKU, los GMP no están libres de fenilalanina y requie-ren de la suplementación de cinco aminoácidos limi-tantes para proporcionar una fuente de completa deproteínas. Además, no son óptimos para su uso en pro-ductos horneados.22
El GMP se produce naturalmente en la leche bovinadentro de la fracción de suero, cuando la K-caseína dela leche de bovino es fraccionada por la acción de laquimiosina.26,44,45,47 Es especialmente adecuado para ladieta PKU como alternativa a las fórmulas de aminoá-cidos, debido a que los concentrados puros de GMP nocontienen aminoácidos aromáticos, incluyendo fenila-lanina. Aislados de GMP a partir del suero del quesocontienen otras proteínas contaminantes del suero,tales como β-lactoglobulina y α-lactoalbúmina, que sícontienen fenilalanina.46 Por lo tanto, el GMP disponi-ble comercialmente contiene entre 2,0-5,0 mg de feni-lalanina por gramo de proteínas.22,47,48 Además, contie-ne de 2 a 3 veces la cantidad de LNAA como isoleuci-na, treonina y valina respecto de otras proteínas dieté-ticas y se debe complementar con aminoácidos esen-ciales para proporcionar una fuente proteica completaen individuos con PKU.22,47
Una dieta basada en aminoácidos -baja en fenilalani-na- proporciona aproximadamente el 80% de las pro-teínas necesarias a partir de aminoácidos sintéticos yel 20% restante se encuentra en las proteínas intactasprovenientes principalmente de frutas y verduras. Encontraste, una dieta basada en GMP, baja en fenilalani-na, proporciona aproximadamente el 70% de las nece-sidades proteicas a partir de las proteínas intactasencontradas en GMP, frutas y verduras, y aproximada-mente el 30% de las necesidades proteicas cubiertascon aminoácidos sintéticos.22
En un estudio realizado por Veldhorst et. al, (2007)49,los sujetos sin PKU consumieron aproximadamente un10% menos en el almuerzo después de un desayunocon suero de leche que incluía GMP en comparacióncon un desayuno con suero de leche que no incluíaGMP.49 Adicionalmente, las personas con PKU a menu-do experimentan hambre como resultado de la inade-cuada distribución de equivalentes proteicos durante eldía y la rápida absorción de los aminoácidos provenien-tes de los alimentos médicos. Estudios efectuados porVan Calcar et. al, (2009)44 evidencian que al consumirGMP en comparación con los aminoácidos, los sujetoscon PKU se sienten satisfechos por más tiempo.22,50,51
En un ensayo ambulatorio efectuado por Macleod et.al, (2010)46, un hombre de 29 años de edad con PKUclásica reemplazó su habitual fórmula prescrita deaminoácidos con productos de GMP durante 10 sema-nas. El promedio de las concentraciones de fenilalani-na en este individuo, medidas en muestras de sangre,
221
fue un 14% inferior con la dieta de GMP en compara-ción con la dieta de aminoácidos. Una explicación deesta respuesta es que el paciente disfrutó de alimentoscon GMP y fue capaz de apreciar a lo largo de los díasque bebía todo de una vez en la mañana.Debido a que los productos de GMP mejoran el sabor, laconveniencia y la variedad de opciones en la dieta PKU,los pacientes pueden estar más dispuestos a consumirestas fuentes durante el día y, por lo tanto, mejorar ladistribución diaria de proteínas.22,50,51 Así, los alimentosmédicos basados en GMP representan un nuevo para-digma, al direccionar las dietas PKU de aminoácidos sin-téticos a una dieta más fisiológica a base de proteínasintactas (GMP), promotoras de la saciedad.22,26,44,45
2.5.3 -Terapia de implementación de ácidos grasospoliinsaturados de cadena largaEn una dieta baja en fenilalanina se deben evitar losalimentos ricos en proteínas (carne, pescado, huevos,hígado y productos lácteos). Estos productos restringi-dos constituyen la fuente dietaria predominante de losácidos grasos poliinsaturados de cadena larga (LC-PUFA), tales como ácido araquidónico (AA) y ácidodocosahexaenoico (DHA). La evidencia disponiblesugiere que los niños con PKU tienen una concentra-ción reducida de AA y de DHA en los fosfolípidos delplasma, eritrocitos y en las membranas en compara-ción con los controles, debido a los planes dietariosestrictos que deben cumplir. Una dieta estricta baja enfenilalanina también es baja en grasa, ácido α-linoléni-co, y está desprovista de cualquier fuente de ácidoeicosapentaenoico (EPA).4,37,52-55
Varios estudios han demostrado que la función neuralen los niños con PKU mejora con la administración dealtas dosis de complementos LC-PUFA37,53,55,56, poniendoen evidencia una mejoría significativa visual de laslatencias potenciales evocadas, de la motricidad fina yde la coordinación.37,53,55,57
Los LC-PUFAs preformados, en particular el AA (C20: 4n-6) y el DHA (C22: 6 n-3), tienen papeles importantesen el desarrollo neurológico.53,58 Estudios previos handemostrado que la alimentación con leche maternaproduce mejores resultados neurológicos, en el largoplazo, que la alimentación con fórmulas, y esto se haatribuido, en parte, a la presencia de LC-PUFA pre-formados en la leche materna, introducidos reciente-mente en las fórmulas infantiles. Los pacientes conPKU representan un grupo vulnerable, para quienes lasuplementación con LC-PUFA durante la infanciapuede ser especialmente beneficiosa.53
Estos niños con PKU se encuentran más expuestos aldaño neuronal debido a los altos picos de Phe en la san-gre, que es en donde los LC-PUFAs ejercen efectos neu-roprotectores. Las dietas vegetarianas generalmenteprescritas tienden a ser muy pobres en LC-PUFAs pre-
formados. La adición de DHA, ya sea en preparadosespeciales de LC-PUFA o en forma de aceite de pescado,para las dietas de los niños mayores con PKU, aumentanlos niveles plasmáticos de estos ácidos grasos.53
Dado que los déficits funcionales reportados en niñoscon PKU bajo tratamiento no pueden ser completa-mente explicados por las variaciones de la Phe en elplasma, éstos pueden deberse, en muchos casos, a lafalta de DHA en la dieta. En un estudio doble ciego rea-lizado por Agostoni et. al, (2000)57, controlado con pla-cebo, 20 niños con PKU (edad promedio 10 años) reci-bieron 500mg/día de LC-PUFA (ambos DHA y ARA) oplacebo (aceite de oliva) durante 12 meses. Estos auto-res demostraron una mejoría en los potenciales visua-les evocados con la introducción de los LC-PUFA yconcluyeron que se requiere un suministro de LC-PUFApre-formados para conseguir una función neuronalnormal en esta población.55 Por todo lo planteado, laintroducción de LC-PUFA es considerado como trata-miento promisorio en el manejo de la dieta PKU.52
2.6. Otros enfoques para el tratamiento de la PKUTener alternativas al tratamiento dietético ha sido elobjetivo de múltiples investigaciones que se hanvisto impulsadas en los últimos 10 años. Si bien anivel dietético se han producido importantes innova-ciones, también se han realizado investigaciones enel tratamiento farmacológico de la fenilcetonuria. Enalgunos casos, los frutos de estas investigaciones yase recogen en la práctica clínica, como es el caso dela tetrahidrobiopterina (BH4); en otros estudios seestán realizando ensayos clínicos en humanos, comoes en la fenilcetonuria amonio liasa (PAL), e investiga-ciones adicionales permanecen todavía en el ámbitode laboratorio.25,26
2.6.1-Terapia encaminada a aumentar la actividadde la FAH: tetrahidrobiopterina (BH4)Partiendo de que existen algunas mutaciones en la enzi-ma fenilalanina hidroxilasa (FAH) asociadas con un fenoti-po (paciente) sensible a la BH4 de la PKU, se han desarro-llado dosis exógenas farmacológicas de BH4 que handado como resultado un incremento en la actividad de laFAH, suficiente para reducir la circulación de fenilalaninaen un nivel terapéuticamente relevante.10,30
Estas mutaciones se suelen presentar con actividadresidual sustancial de la FAH.10 Sin embargo, cuandolas mutaciones en la FAH es diferente, la BH4 puede noejercer su acción sobre ella. Por este motivo, algunospacientes responden a la BH4 y otros no responden. Engeneral, es más probable que un paciente responda ala BH4 cuando sus mutaciones dan lugar a proteínasque ya de por sí conservan cierto grado de función resi-dual, es decir, aquellos pacientes con mutaciones quedan lugar a fenotipos suaves o moderados de PKU.12
TERAPIAS NUTRICIONALES NOVEDOSAS Y OTROS ENFOQUES UTILIZADOS
EN EL TRATAMIENTO DE PACIENTES CON FENILCETONURIA.ARTÍCULO ORIGINAL
YUNIESKY GONZÁLEZ MUÑOZ, CAROLINA PALOMINO CAMARGO,ELEVINA PÉREZ SIRA, ANTONIETA MAHFOUD HAWILOU
222
ACTUALIZACIÓN EN NUTRICIÓN VOL 14 - Nº 3 - SEPTIEMBRE 2013 NUTRICIÓN CLÍNICA
Se han descrito pacientes con respuesta positiva alBH4 de todos los fenotipos, y discrepancias entre elgenotipo y la respuesta (o su ausencia) al BH4, por loque actualmente la única forma de asegurar que unpaciente se puede beneficiar o no con el tratamientocon BH4 es hacer una prueba terapéutica.12 De hecho,desde 1999 un número creciente de pacientes conPKU leve o moderada fueron capaces de disminuir susconcentraciones de fenilalanina plasmática despuésde un ensayo reto a la BH4.37 En efecto, la respuesta ala BH4 es generalmente más pronunciada en los casosde PKU leve o moderada.10,59
Dos formulaciones de BH4 se han estudiado clínica-mente: el 6R-dihidrocloruro de BH4 (LaboratoriosSchircks, Jona, Suiza) y el dihidrocloruro de sapropteri-na (Bio Marin Pharmaceutical Inc), pero sólo el dihidro-cloruro de sapropterina está aprobado por la FDA(Food and Drug Administration de los Estados Unidos)para su uso terapéutico. En algunos pacientes, unadosis diaria única (10-20mg/kg de peso corporal) deeste compuesto es suficiente para mantener una con-centración de fenilalanina en sangre estable durantelas 24h.30 El escenario ideal es que la BH4 sea capaz demantener un excelente control de fenilalanina sanguí-nea sin ningún tratamiento dietético. Sin embargo, sila BH4 se usa en combinación con dieta, hay muchaspreguntas sin respuesta que requieren direcciona-miento y, por otro lado, la disponibilidad de una for-mulación registrada de BH4 ha planteado diversascuestiones prácticas y nuevos interrogantes en el tra-tamiento dietético de estos pacientes.Aproximadamente entre el 20-60% de los pacienteshan mostrado una reducción >30% en los niveles dePhe en la sangre con sapropterina o la formulaciónanterior no registrada de BH4.10
Debido a la falta de estudios, se desaconseja el uso desapropterina en mujeres embarazadas o durante elperiodo de lactancia, aunque las publicaciones hechashasta el momento apuntan que se trata de un medica-mento seguro.12 Estudios realizados sobre posibles efec-tos secundarios del tratamiento con sapropterina handetectado mayor frecuencia de cefalea, rinorrea y trastor-nos gastrointestinales, en los pacientes tratados respectode la población normal. Estos efectos han sido leves ynunca han requerido la suspensión del tratamiento.12,37
La BH4 ha supuesto un antes y un después para muchospacientes. Por desgracia, también ha supuesto unaenorme decepción para todos aquellos pacientes queno son respondedores y que precisamente son los quenecesitan dietas más restrictivas. El éxito conseguidocon algunos pacientes, y también la falta de respuestaen otros, ha incentivado la investigación de nuevas tera-pias para la fenilcetonuria en la última década.12
2.6.2-Terapia encaminada a suplantar la actividadde la FAH: Fenilalanina amonioliasaLa fenilalanina amonio liasa (PAL, por sus siglas eningles) es una enzima de origen vegetal, que degradala fenilalanina (sin síntesis de tirosina) a amonio yácido transcinámico, productos que pueden ser elimi-nados por la orina. En comparación con la FAH huma-na, la PAL es estructural y catalíticamente menos com-pleja, físicamente más estable, y no requiere una coen-zima (figura 5).10-12,60,61 Hasta el momento, su uso nohabía sido posible por su alta capacidad inmonogéni-ca, pero en los nuevos estudios se utiliza una presen-tación en la que la proteína ha sido recubierta por unacapa glucídica (pegilada, peg-PAL) que reduce la for-mación de anticuerpos. Con esta nueva presentaciónse han obtenido estudios muy prometedores.10,12,62 Laformulación (PEG-PAL) de la PAL se encuentra actual-mente en investigación clínica intensiva como unposible tratamiento clínico alternativo para los pacien-tes con PKU.10,26
En un estudio realizado por Kang et. al, (2010)61 dirigi-do al desarrollo de una forma oral de esta enzima, laestabilidad de la PAL mejoró ligeramente frente a ladigestión proteolítica intestinal, por lo que es poten-cialmente útil para la aplicación oral.11 En forma recien-te, Sarkissian et. al, (2011)63, en un estudio modelo enratones con PKU, destaca que la PEG-PAL administradapor vía oral, mostró resultados prometedores con unareducción media del nivel de Phe sanguínea de alrede-dor del 40% y sin reacciones adversas graves.10,63
Otra forma creada para el suministro de la PAL esmediante la implantación subcutánea.10-12,60 En estudiosmodelo con ratones con PKU, la inyección subcutáneade la enzima PAL produjo una completa corrección delas concentraciones de fenilalanina en la sangre, y esteefecto se mantuvo durante un máximo de un año conla administración semanal de inyecciones con enzi-mas.11 Sin embargo, se deben investigar todavía lasposibles reacciones adversas y, sobre todo, la respues-ta inmune en el largo plazo. Estos estudios son muyesperanzadores y este tratamiento podría ser útil paratodos los pacientes, independientemente de su geno-tipo/fenotipo.30
2.6.3-Terapia encaminada al restablecimiento de laactividad FAH: Terapia génicaDado que la fenilcetonuria es una enfermedad genéti-ca debido a mutaciones en el gen que codifica la FAH,en teoría, si se consiguiese introducir en el cuerpo ungen normal, se podría restablecer la actividad de laFAH y literalmente curar la enfermedad. En los últimosaños esta idea ha dejado de ser una posibilidad remo-ta.12 Un estudio realizado por Rebuffat et. al, (2010)64
reportó la restauración de la actividad hepática de laFAH después de la inyección intramuscular de vecto-
223
res de genes de FAH en ratones deficientes en estaenzima. Un enfoque similar efectuado por Jung et. al,(2008)65 protegió a la descendencia de ratones defi-cientes en FAH de los efectos teratogénicos de la PKU.Otro estudio en animales (Ding et. al, 2008)66, mostróefectos benéficos de la expresión simultánea de la FAHjunto con otras dos enzimas de la ruta biosintética delBH4. El trasplante de células con funcionamientopleno del metabolismo FAH/BH4 o incluso el trasplan-te hepático son enfoques alternativos.30
Además, se han utilizado vectores de adenovirus en estu-dios murinos con resultados muy esperanzadores. En unratón modelo (Harding et al, 2006)67, la terapia génica diri-gida al hígado permitió la corrección durante un año dehiperfenilalaninemia. Sin embargo, esta terapia génicadirigida al hígado no conduce a una corrección perma-nente de la actividad de la FAH. El genoma del vector nose integra en el ADN del hepatocito y la gradual, perocontinua, regeneración hepática hace que la actividad dela FAH se pierda progresivamente y que las reinyeccionesdel mismo vector serotipo no sean efectivas ya que éstees destruido por reacción inmune.11,12
El músculo esquelético es un órgano diana atractivopara la terapia génica, ya que no sufre una división
celular continua y es más fácilmente accesible. Estaaproximación es complicada ya que no sólo hay queincluir el gen de la FAH sino todo el sistema enzimáti-co de producción de su cofactor, la BH4. No obstante,este tratamiento ha sido probado con resultados pro-metedores en ratones, por lo que resulta muy prome-tedor en un futuro no muy lejano.11,12
2.6.4- La encapsulación de células como terapiapotencialEn un trabajo realizado por Santillan et al. (2009)68 titu-lado: “La encapsulación de células como una potencialterapia no dietética para la fenilcetonuria materna”, sepropusieron determinar si las células que sobre-expre-san la FAH podrían disminuir significativamente lafenilalanina in vitro. Para ello, los investigadores proba-ron el efecto de la encapsulación de estas células den-tro de microesferas de alginato para evaluar su capaci-dad de expresar la FAH y metabolizar la Phe in vitro.Con tal propósito, los autores trabajaron con líneas decélulas humanas 293T y WRL68, las cuales fueron transi-toriamente y de forma estable transfectadas para sobre-expresar la FAH. Posteriormente, las células fueronencapsuladas dentro de microesferas de alginato sódi-
TERAPIAS NUTRICIONALES NOVEDOSAS Y OTROS ENFOQUES UTILIZADOS
EN EL TRATAMIENTO DE PACIENTES CON FENILCETONURIA.ARTÍCULO ORIGINAL
YUNIESKY GONZÁLEZ MUÑOZ, CAROLINA PALOMINO CAMARGO,ELEVINA PÉREZ SIRA, ANTONIETA MAHFOUD HAWILOU
co y se efectuaron mediciones cronometradas de la Pheen los medios. Ambas células con sobre- expresión de laFAH (encapsuladas y no encapsuladas) redujeron enforma significativa la concentración de Phe in vitro. Estos resultados se perfilan para el uso de una terapiaalternativa, pues las células encapsuladas dentro demicroesferas de alginato podrían ser implantadas, enun futuro no muy lejano, en la cavidad peritoneal. Lasmicroesferas actuarían para aislar células del sistemainmune y las células encapsuladas permitirían el pasode sustancias de bajo peso molecular, tales comonutrientes, oxígeno, electrolitos, y aminoácidos, perofísicamente impedirían la difusión o el transporte acti-vo de moléculas más grandes, tales como anticuerposo células del sistema inmune.
3. ConclusionesEl desafío más grande para vivir con PKU es el cumpli-miento durante toda la vida de una dieta que sólo per-mite un consumo reducido de alimentos naturales yrequiere una ingesta suficiente de fórmulas basadasen aminoácidos para proporcionar una nutrición ade-cuada. Sin embargo, la comprensión de la base genéti-ca de la fisiopatología y el manejo de la fenilcetonuriase han incrementado sustancialmente en los últimosaños. Esto ayudó en la compresión de la necesidad demantener el control de las concentraciones de fenilala-nina en sangre, durante y después de la infancia, paralograr los mejores resultados neuropsicológicos, y labúsqueda de terapias alternativas, tanto nutricionalescomo no nutricionales.Desde el punto de vista nutricional, las terapias nove-dosas constituyen una solución alternativa a la estrictadieta aplicada de manera tradicional. Específicamente,
los glicomacropéptidos prometen mejorar el sabor, lavariedad y la aceptabilidad de la dieta baja en Phe. Lasuplementación con LNNA representa una terapianutricional prometedora pero debe ser estudiada enforma detallada. La administración de LC-PUFA ayudaa enfrentar el daño neuronal generado por las altasconcentraciones de Phe en la sangre. En cuanto a los nuevos enfoques terapéuticos nonutricionales, como la reciente introducción de dihi-drocloruro de sapropterina (formulación de BH4) esprobable que el mismo contribuya a la gestión de lafenilcetonuria en un subconjunto de pacientes queresponden bien a este tratamiento. En un futuro próxi-mo, los nuevos tratamientos como fenilalanina amo-nio liasa y, más adelante, la terapia génica, podrían ali-viar la carga considerable de la restricción dietética defenilalanina en pacientes PKU y sus familiares. La histo-ria de la PKU es rica en logros y el futuro de las personasque viven con PKU avizora venideros años alentadores.
224
ACTUALIZACIÓN EN NUTRICIÓN VOL 14 - Nº 3 - SEPTIEMBRE 2013 NUTRICIÓN CLÍNICA
Camp K, Lloyd-Puryear M, Huntington K. Nutritional tre-atment for inborn errors of metabolism: Indications,regulations, and availability of medical foods and dietarysupplements using Phenylketonuria as an example.Molecular Genetics and Metabolism 2012; 107: 3–9.
Acosta PB, Yanicelli S. The Ross Metabolic FormulaSystem, Nutrition Support Protocols, Ross ProductsDivision, Division of Abbott Laboratories, Columbus,Ohio. 2001.
Weaver MA, Johnson A, Singh RH, Wilcox WR, Lloyd-Puryear MA, Watson MS. Medical foods: inborn errors ofmetabolism and the reimbursement dilemma. Genet.Med. 2010;12:364-369.
Fekete K, Decsi T. Long-Chain Polyunsaturated fatty acids ininborn errors of metabolism. Nutrients 2010; 2:965-974.
Cornejo V, Manríquez V, Colombo M, et al.Fenilquetonuria de diagnóstico neonatal y lactanciamaterna. Rev Méd Chile 2003; 131: 1280-1287.
Equip de Seguiment de PKU Hospital Sant Joan de Déu. PKU?Editorial-Gráficas Signo, S.A., Barcelona, España. 1997.
Thureen P, Hay W. Neonatal Nutrition and Metabolism.Second Edition. Cambridge University Press. New York. 2006.
Ruiz M, Sánchez F, Dalmau J. Nutritional treatment ofinborn errors of metabolism. Editorial: ERGON, Madrid;España. 2007.
Giovannini M,Verduci E, Salvatici E, Fiori L, Riva E.Phenylketonuria: Dietary and therapeutic challenges. JInherit Metab Dis. 2007; 30:145–152.
BIBLIOGRAFÍA
1-
2-
3-
4-
5-
6-
7-
8-
9-
225
Giovannini M, Verduci E, Salvatici E, Paci S, Riva E.Phenylketonuria: nutritional advances and challenges.Nutrition and Metabolism 2012; 9:7.
Bélanger A, Burlina A, Harding C, Muntau A. Up to dateknowledge on different treatment strategies forPhenylketonuria. Molecular Genetics and Metabolism2011; 104:19–25.
Bélanger A, Ramírez M. Nuevos tratamientos en PKU.Hospital Ramón y Cajal. (Portal web). 2012.
Alfonso, J. B. Historia de la PKU. Metabólico 2009; 44.
Shawn, C. E. Asbjørn Følling and the Discovery ofPhenylketonuria. Journal of the history of the neuros-ciences S.f.;1-10.
Pereda TL, Calcáneo GJ, Enriquéz TR, Badillo BE, Soler HE.Identificación de un caso de fenilcetonuria a través deltamizaje neonatal. Bol. Med. Hosp. Mex. 2008; 65 (Julio-Agosto), 290-296.
Penrose L, Quastel JH. Metabolic studies inPhenylketonuria. XXXVIII 1937; 266-274.
Jervis JA. Studies on Phenylpyruvic oligophrenia. Theposition of the metabolic error. 1947, 651-656.
Ziesch B, Weigel J, Thiele A, et al. Tetrahydrobiopterin(BH4) in PKU: effect on dietary treatment, metabolic con-trol, and quality of life. J Inherit Metab Dis. 2012;35:983–992.
Singh J, Yung S, Shi P. Clinical therapeuties forPhenylketonuria. Drug Deliv. and Trans. Res. (Springer). 2012.
Marjorie Y. Manejo nutricional en pacientes con fenilce-tonuria. Instituto de Errores Innatos del MetabolismoI.E.I.M. Facultad de ciencias, Pontificia UniversidadJaveriana, Colombia (Portal web). 2012.
Fundación Ahdonay. La Fenilcetonuria (PKU). Argentina.(Portal web). 2012.
Van Calcar S, Ney D. Food Products Made withGlycomacropeptide, a Low-Phenylalanine Whey Protein,Provide a New Alternative to Amino Acid–Based MedicalFoods for Nutrition Management of Phenylketonuria.Journal of the Academy of Nutrition and Dietetics 2012;August 112(8):1201-1210.
Ramírez C, Pérez E, Ibarra I, Vela M. Controversias en laclasificación de las hiperfenilalaninemias. Propuesta deunificación. Acta Pediatr Mex. 2007; 28(6):261-9.
Cueto D, Pérez E. Formulación de mezclas para torta y pan-queca a base de harina de yuca enriquecida para dietas conregímenes especiales. Tesis de Doctorado. Instituto deCiencia y Tecnología de los Alimentos – Universidad Centralde Venezuela, Caracas, Venezuela. 2011.
González YM, Palomino CC, Pérez ES. Fórmulas infantilespara fenilcetonúricos (PKU). Seminario II del Postgradoen Ciencia y Tecnología de los Alimentos. Instituto deCiencia y Tecnología de Alimentos – Universidad Centralde Venezuela. Caracas, Venezuela. 2012.
Feillet F, van Spronsen FJ, MacDonald A, et al. Challengesand Pitfalls in the Management of Phenylketonuria.Pediatrics 2010; 126(2):333-341.
Belmont L, Fernández C, Ibarra I, Guillén S, Monroy S, VelaM. Evaluación bioquímica de la fenilcetonuria (PKU): deldiagnóstico al tratamiento. Acta Pediatr Mex. 2012;33(6):296-300.
Guthrie R, Susi A. A simple Phenylalanine method fordetecting Phenylketonuria in a large population of new-born infants. Pediatrics. 1963; 32:702-6.
Vela M, Cicerón I, Pérez M, et al. Interpretación del tamizmetabólico. Análisis de aminoácidos. Acta Pediatr Mex.2002; 23: 21-7.
Blau N, Van Spronsen F, Levy H. Phenylketonuria. Lancet2010; 376:1417–27.
Van Rijn M. Dietary treatment in Pku from experience toevidence. Trabajo de Tesis Doctoral. 136 p. 2007.
Levy H, Burton B, Cederbaum S, Scriver C.Recommendations for evaluation of responsiveness totetrahydrobiopterin (BH4) in Phenylketonuria and its usein treatment. Mol Genet Metab 2007; 92: 287–91.
Blau N, Belanger QA, Demirkol M, et al. Optimizingthe use of sapropterin (BH4) in the management ofPhenylketonuria. Mol Genet Metab 2009; 96:158–63.
Blau N. Defining tetrahydrobiopterin (BH4)-responsive-ness in PKU. J Inherit Metab. Dis. 2008; 31: 2–3.
Hellekson K. Practice Guidelines NIH ConsensusStatement on Phenylketonuria. Am Fam Physician. 2001Apr 1; 63(7):1430-1432.
Ahring K, Belánger A, Dokoupil K, et al. Dietary manage-ment practices in Phenylketonuria across European cen-tres. Clinical Nutrition 2009; 28:231–236.
MacDonald A, Gökmen H, Daly A. Changing dietary prac-tices in Phenylketonuria. The Turkish Journal of Pediatrics2009; 51: 409-415.
Enns GM, Koch R, Brumm V, Blakely E, Suter R, Jurecki E.Suboptimal outcomes in patients with PKU treated earlywith diet alone: Revisiting the evidence. Mol GenetMetab. 2010; 101(2-3):99-109.
Pietz J, Kreis R, Rupp A, et al. Large neutral amino acidsblock Phenylketonuria transport into brain tissue in
10-
11-
12-
13-
14-
15-
16-
17-
18-
19-
20-
21-
22-
23-
24-
25-
26-
27-
28-
29-
30-
31-
32-
33-
34-
35-
36-
37-
38-
39-
TERAPIAS NUTRICIONALES NOVEDOSAS Y OTROS ENFOQUES UTILIZADOS
EN EL TRATAMIENTO DE PACIENTES CON FENILCETONURIA.ARTÍCULO ORIGINAL
YUNIESKY GONZÁLEZ MUÑOZ, CAROLINA PALOMINO CAMARGO,ELEVINA PÉREZ SIRA, ANTONIETA MAHFOUD HAWILOU
226
ACTUALIZACIÓN EN NUTRICIÓN VOL 14 - Nº 3 - SEPTIEMBRE 2013 NUTRICIÓN CLÍNICA
patients with Phenylketonuria. J Clin Invest 1999;103:1169–1178.
Matalon R, Michals-Matalon K, Bhatia G, et al. Doubleblind placebo control trial of large neutral amino acids intreatment of PKU: effect on blood Phenylalanine. J.Inherit Metab Dis 2007, 30:153-158.
Matalon R, Michals-Matalon K, Bhatia G, et al. Large neu-tral amino acids in the treatment of Phenylketonuria(PKU). J Inherit Metab Dis 2006; 29:732-738.
Li XM, Srivastova K, Grishin A et al. Persistent protectiveeffect of heat-killed Escherichia coli producing “engineered,”recombinant peanut proteins in a murine model of peanutallergy. J Allergy Clin Immunol. 2003; 112(1):159-167.
Lim K, Van Calcar SC, Nelson KL, Gleason ST, Ney DM.Acceptable low-Phenylalanine foods and beverages canbe made from glycomacropeptide from cheese whey forindividuals with PKU. Mol Genet Metab. 2007; 92(1-2):176-178.
van Calcar SC, MacLeod EL, Gleason ST, et al. Improvednutritional management of Phenylketonuria by using adiet containing glycomacropeptide compared withamino acids. Am J Clin Nutr. 2009; 89(4):1068-1077.
Laclair CE, Ney DM, MacLeod EL, Etzel MR. Purificationand use of glycomacropeptide for nutritional manage-ment of Phenylketonuria. J Food Sci 2009; 74:199-206.
MacLeod EL, Clayton M, van Calcar SC, Ney DM.Breakfast with glycomacropeptide compared withamino acids suppresses plasma ghrelin levels inindividuals with Phenylketonuria. Mol Genet Metab.2010; 100(4):303-308.
Etzel MR. Manufacture and use of dairy protein fractions.J Nutr. 2004;134 (suppl 4):996-1002.
MacDonald A, Evans S, Cochrane B, Wildgoose J.Weaning infants with Phenylketonuria: a review. Journalof Human Nutrition and Dietetics 2012; 25:103–110.
Veldhorst MA, Nieuwenhuizen AG, Hochstenbach-Waelen A, et al. Effects of complete whey-protein break-fasts versus whey without GMP-breakfast on energy inta-ke and satiety. Appetite 2009; 52(2):388-395.
Hall WL, Mullward DJ, Long SJ, Morgan LM. Casein andwhey exert different effects on plasma amino acid profi-les, gastrointestinal hormone secretion and appetite. Br JNutr. 2003; 89(2):239-248.
Ney DM, Gleason ST, van Calcar SC, et al. Nutritionalmanagement of PKU with glycomacropeptide from che-ese whey. J Inherit Metab Dis. 2009; 32(1):32-39.
Cleary MA, Feillet F, White FJ, et al. Rutherford PJ.Randomised controlled trial of essential fatty acid sup-
plementation in Phenylketinuria. Eur. J. Clin. Nutr. 2006;60:915-920.
Feillet F, Agostoni C. Nutritional issues in treatingPhenylketonuria. J Inherit Metab Dis. 2010; 33:659–664.
Koletzko B, Sauerwald T, Demmelmair H, et al. Dietarylong-chain polyunsaturated fatty acid supplementationin infants with Phenylketonuria: a randomized controlledtrial. J Inherit Metab Dis. 2007; 30:326–332.
Ryan S, Astwood J, Gautier S, Kuratko C, Nelson E, SalemN. Effects of long-chain polyunsaturated fatty acid sup-plementation on neurodevelopment in childhood: Areview of human studies. Prostaglandins, Leukotrienesand Essential Fatty Acids 2010; 82:305–314.
Koletzko B, Beblo S, Demmelmair H, Hanebutt FL.Omega-3 LC-PUFA supply and neurological outcomes inchildren with Phenylketonuria (PKU), J. Pediatr.Gastroenterol. Nutr. 2009; 48:2–7.
Agostoni C, Massetto N, Biasucci G, et al. Effects of long-chain polyunsaturated fatty acid supplementation on fattyacid status and visual function in treated children withhyperPhenylalaninemia. J. Pediatr. 2000; 137:504-509.
Belkind GJ, Carreón RA, Contreras OC, Estrada MS, ParraCM, Fatty acids and neurodevelopment, J.Pediatr.Gastroenterol. Nutr. 2008; 47:7–9.
Burton BK, Bausell H, Katz R, Laduca H, Sullivan C.Sapropterin therapy increases stability of bloodPhenylalanine levels in patients with BH4-responsivePhenylketonuria (PKU), Mol. Genet. Metab. 2010;101:110–114.
Sarkissian C, Gámez A. Phenylalanine ammonia lyase,enzyme substitution therapy for Phenylketonuria, whereare we now? Molecular Genetics and Metabolism 2005;86:22–26.
Kang TS, Wang L, Sarkissian CN, Gámez A, Scriver CR,Stevens RC. Converting an injectable protein therapeuticinto an oral form: Phenylalanine ammonia lyase forPhenylketonuria, Mol. Genet. Metab. 2010; 99:4–9.
Gamez A, Sarkissian C, Wang L, et al. Development ofpegylated forms of recombinant Rhodosporidium toru-loides Phenylalanine ammonia-lyase for the treatment ofclassical Phenylketonuria, Mol. Ther. 2005; 11:986–989.
Sarkissian CN, Kang TS, Gámez A, Scriver CR, Stevens RC.Evaluation of orally administered PEGylated Phenylalanineammonia lyase in mice for the treatment ofPhenylketonuria. Mol Genet Metab. 2011; 104:249-254.
Rebuffat A, Harding CO, Ding Z, Thony B. Comparison ofAAV pseudotype 1, 2, and 8 vectors administered byintramuscular injection in the treatment of murinePhenylketonuria. Hum Gene Ther 2010; 21: 463–77.
40-
41-
42-
43-
44-
45-
46-
47-
48-
49-
50-
51-
52-
53-
54-
55-
56-
57-
58-
59-
60-
61-
62-
63-
64-
227
Jung SC, Park JW, Oh HJ, et al. Protective eff ect of recom-binant adeno-associated virus 2/8-mediated gene the-rapy from the maternal hyperPhenylalaninemia in offsprings of a mouse model of Phenylketonuria. J KoreanMed Sci 2008; 23: 877–83.
Ding Z, Harding CO, Rebuff at A, Elzaouk L, Wolff JA,Thony B. Correction of murine PKU following AAV-media-ted intramuscular expression of a completePhenylalanine hydroxylating system. Mol Ther 2008; 16:673–81.
Harding CO, Gillingham MB, Hamman K, et al. Completecorrection of hyperPhenylalaninemia following liverdi-rected, recombinant AAV2/8 vector-mediated gene the-rapy in murine Phenylketonuria, Gene Ther. 13 (2006)457–462.
Santillan D; Santillan M, Hunter S. Cell encapsulation as apotential nondietary therapy for maternalPhenylketonuria. Am J Obstet Gynecol. 2009:201-289.
65-
66-
67
68-
TERAPIAS NUTRICIONALES NOVEDOSAS Y OTROS ENFOQUES UTILIZADOS
EN EL TRATAMIENTO DE PACIENTES CON FENILCETONURIA.ARTÍCULO ORIGINAL
YUNIESKY GONZÁLEZ MUÑOZ, CAROLINA PALOMINO CAMARGO,ELEVINA PÉREZ SIRA, ANTONIETA MAHFOUD HAWILOU