Arritmias 12 FA Cardioversion.pdf
Transcript of Arritmias 12 FA Cardioversion.pdf

227
Fibrilación auricular: indicaciones de cardioversión y posterior tratamiento para
mantener el ritmo sinusal
Capítulo 12
J.L. Salinas Arce, N. Pérez-Castellano
Unidad de Arritmias.
Hospital Clínico San Carlos. Madrid
INTRODUCCIÓN
La fibrilación auricular (FA) es reconocida junto con la insuficiencia cardíaca y la diabetes mellitus tipo 2, como una de las tres epidemias cardiovasculares del siglo XXI. Estudios observacionales como el Framingham Heart Study(1) han mostra-do una importante asociación entre esta arritmia y el riesgo de accidente cerebrovas-cular, insuficiencia cardíaca y muerte; en forma independiente de la severidad de la cardiopatía de fondo.
Su manejo terapéutico ha evolucionado a pasos agigantados, desde el uso irracio-nal de glucósidos, a fármacos antiarrítmicos (AA) más selectivos y procedimientos invasivos de ablación con resultados muy prometedores. Aunque la restauración y mantenimiento del ritmo sinusal ha sido considerada durante muchos años como la estrategia de tratamiento ideal, los resultados de múltiples estudios que compararon esta conducta frente al control de la frecuencia demostraron ser equivalentes incluso en mortalidad; todo esto, unido a la comprensión de los múltiples mecanismos res-ponsables de la FA, hace que esta arritmia no sea una enfermedad simple, sino que, por el contrario, se trate de un complejo fisiopatológico que requiere un tratamien-to individualizado.
En el presente capítulo haremos una descripción de los conceptos actuales en el manejo farmacológico y eléctrico de la FA, haciendo énfasis en sus indicaciones y medidas para prevenir complicaciones.

Arrit
mia
s: m
anej
o pr
áctic
o
228
CARDIOVERSIÓN
Se define como cardioversión (CV) la recuperación del ritmo sinusal de forma espontánea o inducida con terapia eléctrica o farmacológica. La tasa de CV espontá-nea de la FA de reciente inicio es cercana al 20 % en 3 horas, al 60 % a las 24 horas, y al 80 % a las 48 horas. Sin embargo, un grupo de pacientes requiere de una actitud terapéutica basada en los siguientes principios:
• Prevención de complicaciones embólicas mediante el uso de antiagregantes pla-quetarios o anticoagulación.
• Control de la frecuencia cardíaca (FC) y/o recuperación del ritmo sinusal.La probabilidad de mantener el ritmo sinusal después de la CV es uno de los factores
más importantes a tener en cuenta cuando se decide un procedimiento electivo. Entre los marcadores más importantes de recurrencia de la FA tenemos un tiempo de evolu-ción mayor de un año y una AI con diámetros mayores de 45-50 mm(2-4). Otros factores a considerar son la presencia de cardiopatía estructural secundaria a valvulopatía mitral, una clase funcional deteriorada o episodios de insuficiencia cardíaca previos.
En términos generales, la decisión de realizar una CV está justificada en aquellas FA con compromiso grave de la estabilidad clínica del paciente, en los casos de FA secun-daria, una vez resuelta la causa (hipertiroidismo, embolismo pulmonar, intoxicaciones o períodos posquirúrgicos), y como opción general en un primer episodio o como parte de una estrategia a largo plazo (medicación antiarrítmica, ablación con radiofrecuencia)(5).
Si se decide realizar CV, debe tenerse en cuenta que no existen diferencias en el riesgo de cardioembolismo ni de disfunción mecánica auricular entre ambas formas de CV, siendo las medidas de prevención iguales en todos los casos.
Cardioversión eléctrica
En el año 1920 una compañía eléctrica americana informó de la muerte de un gran número de sus trabajadores por complicaciones en la manipulación de sus equipos. Al tra-tar de encontrar una explicación a esto, investigadores de la Universidad John Hopkins descubrieron que las descargas eléctricas podían inducir fibrilación ventricular y, a su vez, suprimir éstas. El potencial enfoque terapéutico de la liberación de descargas eléctricas para suprimir las arritmias cardíacas basó su perfil de seguridad en los estudios de Lown et al., quienes en 1962 aplicaron, por primera vez, la CV eléctrica (CVE) sincronizada(6).
Durante más de cuatro décadas la CVE transtorácica ha sido el método más efecti-vo para restaurar el ritmo sinusal en pacientes con FA, con una tasa de éxito del 75 al 93 % y con una relación inversa con la duración de la FA (éxito sólo del 50 % en FA de más de 5 años de duración) y con el tamaño auricular(7,8). Los datos del Euro Heart Survey, un registro de 5.333 pacientes con FA de 35 países europeos, muestran una efectividad del 89 % para la CVE(9).
Mecanismos
La CVE sincronizada con la onda R del ECG libera una descarga eléctrica duran-te una fase no vulnerable del ciclo cardíaco. Aunque existe alguna controversia sobre los mecanismos responsables de la interrupción de la fibrilación, se ha propuesto una

229
Fibr
ilaci
ón a
uric
ular
: ind
icac
ione
s de
car
diov
ersi
ón y
pos
terio
r tra
tam
ient
o […
]
serie de teorías, siendo la más aceptada la “hipótesis de la masa crítica”, por la cual para cardiovertir una arritmia es necesario despolarizar de forma uniforme una canti-dad de miocardio igual o mayor a la requerida por la arritmia para sostenerse(10).
El éxito de la CVE depende principalmente de dos factores: la cantidad de energía que viaja a través del miocardio y la impedancia torácica. Ambas están relacionadas con el tamaño y composición de las palas, el medio de contacto con la piel, el tamaño corporal, el ciclo respiratorio y el tipo de energía liberada(11). Los avances tecnológi-cos y los diferentes estudios clínicos han permitido generar algunas recomendaciones básicas, con el objetivo de incrementar la tasa de éxito:
• Medios de contraste. Utilizar geles de electrolitos o solución salina como medios de contacto entre la piel y las palas; de esta forma se disminuye la resistencia.
• Tamaño de las palas. Se recomiendan palas con un área de 8-12 cm2, ya que las de menor tamaño originarían mayor densidad de corriente y daño tisular.
• Configuración de las palas. De forma clásica se ha empleado la configuración ápex-esternón. Sin embargo, la configuración anteroposterior (la pala anterior situa-da a la izquierda del esternón en el 3.er espacio intercostal y la pala posterior por deba-jo del ángulo de la escápula izquierda) tiene tasas de éxito de entre el 87 y el 95 % en series de pacientes con FA persistente(12,13). Con esta modalidad, el vector eléctrico lograría atravesar ambas aurículas y aumentar, así, su probabilidad de CV.
• Cantidad de energía y forma de onda. Los desfibriladores monofásicos han sido los más utilizados hasta hace pocos años. Se basan en la liberación de una onda de energía en una sola dirección y con forma sinusoidal. Por el contrario, los desfibri-ladores bifásicos liberan una onda de energía que cambia de dirección en un tiempo determinado. Con estos últimos dispositivos se han conseguido menores umbrales de desfibrilación y mayores tasas de éxito, disminuyendo la energía requerida hasta en un 45 % y siendo en la actualidad la modalidad empleada en los desfibriladores implan-tables. Mittal et al.(14), en un estudio prospectivo aleatorizado, demostró una superio-ridad significativa de los desfibriladores bifásicos sobre los monofásicos en la CV de FA persistente, con mayores tasas éxito, menor número de descargas y menor cantidad de energía empleada. No existen diferencias en cuanto a efectividad y energía reque-rida, entre los diferentes tipos de desfibriladores bifásicos(15) (Tabla 1). Con respecto a la cantidad inicial de energía que debe emplearse, existe controversia entre dos ten-dencias. La primera recomienda dosis progresivas de energía, iniciando con 100 J en el bifásico y 200 J en el monofásico; por otro lado, se recomienda iniciar la CV con dosis máximas, de 200 o 360 J, respectivamente, con el objeto de disminuir la canti-dad total de energía empleada; esta última es la conducta asumida en nuestra Unidad de Arritmias. Ambas técnicas han demostrado ser eficaces y no tener diferencias en sus complicaciones. En el caso de la FA persistente, se recomienda realizar la CVE con la máxima energía, a excepción de la FA con evolución menor de 24 horas, en la cual se podrían utilizar dosis menores.
Indicaciones de cardioversión eléctrica
Las actuales guías de manejo de la FA(16) y diferentes autores recomiendan la CVE en aquellas situaciones clínicas asociadas a la FA que comprometan la estabilidad hemodinámica del paciente: angina, insuficiencia cardíaca o hipotensión; en los casos

Arrit
mia
s: m
anej
o pr
áctic
o
230
de síndrome de Wolff-Parkinson-White con conducción rápida o como parte de una estrategia de manejo a largo plazo, que pueda incluir el uso previo de fármacos AA (Tabla 2). Estas indicaciones tiene un nivel de evidencia basado en estudios no alea-torizados o como opinión de expertos.
La conducta de una CVE temprana puede evitar el remodelamiento eléctrico de la aurícula, previniendo la disfunción auricular, reduciendo su tamaño e incrementando el tiempo de recurrencia. Sin embargo, esta conducta no ha demostrado valor prácti-co en diferentes estudios(17).
Aunque la CVE está contraindicada en aquellos pacientes con intoxicación digitálica o hipopotasemia por los riesgos de generar arritmias refractarias, la limitación es relati-va y su uso no debe ser demorado cuando se requiera en situaciones de urgencia.
Tabla 1. Éxito de la cardioversión eléctrica en la fibrilación auricular
Tipo de cardioversión Éxito
• Cardioversión externa– Desfibriladores monofásicos
Configuración ápex-esternón
– Desfibriladores bifásicos:Configuración anteroposteriorUso de mayor energía (2 desfibriladores)Energía con ajuste automático a impedancia
• Cardioversión interna– Catéteres intracavitarios– Desfibriladores intraesofágicos
75-93 %
90-100 %84 %*
85-92 %*
70-90 %77 %
* Éxito en aquellos casos refractarios a procedimientos convencionales.
Tabla 2. Indicaciones para cardioversión eléctrica en la fibrilación auricular*
Tipo de indicaciónNivel de
evidencia
Clase I1. Control inadecuado de la FC con fármacos en el contexto de
isquemia miocárdica, hipotensión sintomática, angina o insuficiencia cardíaca
2. CV inmediata en FA y preexcitación con taquicardia rápida o hipotensión sintomática
3. Síntomas de FA inaceptables o previa administración de fármacos AA
C
CC
Clase IIA1. Estrategia de manejo a largo plazo B
Clase III1. Recurrencias frecuentes incluso con fármacos C
* Guía de manejo del paciente con fibrilación auricular ACC/AHA/ESC 2006(16).

231
Fibr
ilaci
ón a
uric
ular
: ind
icac
ione
s de
car
diov
ersi
ón y
pos
terio
r tra
tam
ient
o […
]
Existen diferentes protocolos de CVE; sin embargo, es recomendable que cada ins-titución establezca el suyo, con el fin de optimizar los recursos propios y disminuir las complicaciones. En el Anexo presentamos el Protocolo de cardioversión eléctrica de la Unidad de Arritmias del Hospital Clínico San Carlos
Seguridad y complicaciones
La información proporcionada por un metaanálisis(18) en el que se incluyeron los estudios RACE (Rate control versus Electrical cardioversion for persistent atrial fibril-lation)(19), HOT CAFE (Rhythm control versus rate control in patients with persistent atrial fibrillation)(20) y STAFF (Strategies of Treatment of Atrial Fibrillation)(21) mues-tra que la CVE no presenta diferencias en mortalidad, embolismo periférico, rehospi-talización y calidad de vida con respecto a los pacientes que siguieron una actitud tera-péutica de control de frecuencia.
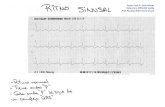
Las complicaciones cardioembólicas son, con diferencia, las más importantes y frecuentes, llegando hasta un 7 % en pacientes que no reciben anticoagulación pro-filáctica(22,23); sin embargo, se han descrito otras complicaciones potenciales, como quemaduras eléctricas, fibrilación ventricular yatrogénica, asistolia auricular prolon-gada y complicaciones propias de la anestesia, entre las más frecuentes. En ocasio-nes, puede aparecer una elevación transitoria del segmento ST en el ECG después de la CV (Figura 1), lo cual no se ha correlacionado con elevación en marcadores de daño miocardíaco.
Cardioversión en portadores de marcapasos y desfibriladores
La CV de FA en pacientes portadores de marcapasos y desfibriladores es segura cuando se toman las medidas de precaución general. Los circuitos de los dispositivos están protegidos contra descargas eléctricas externas, pero pueden aparecer fallos en la programación o elevaciones temporales de los umbrales de estimulación.
El utilizar desfibriladores bipolares y una disposición de las palas anteroposterior disminuye la posibilidad de complicaciones(24); además, algunos autores recomiendan programar el marcapasos en modo VOO antes de la CV. Como regla general, se reco-mienda realizar una evaluación completa del funcionamiento de los equipos antes y después de la CVE. Del mismo modo, el empleo de este tipo de CV en pacientes ges-tantes no ha demostrado incrementar las complicaciones en la madre o en el feto(25).
Cardioversión interna
La aplicación de bajas dosis de energía (< 20 J) con catéteres en la aurícula dere-cha y el seno coronario es efectiva en restaurar el ritmo sinusal en un 70-90 % de los casos, requiriendo sólo la sedación de los pacientes.
Con esta técnica, se han descrito resultados superiores, en especial en pacientes obesos o con enfermedad pulmonar obstructiva; sin embargo, debido a su carácter invasivo, su indicación actual está limitada a los casos refractarios a la CVE externa.
Lukoshevichiute propuso el uso de electrodos intraesofágicos para la CV, consi-guiendo tasas de éxito hasta del 77 % en los casos en que la CVE fue inefectiva(26).

Arrit
mia
s: m
anej
o pr
áctic
o
232
Cardioversión farmacológica
La CV farmacológica (CVF) es la recuperación del ritmo sinusal mediante el uso de fármacos AA y se basa en la modificación de las propiedades electrofisiológicas de la aurícula que permiten el sostenimiento de la FA.
No se han diseñado estudios comparativos entre las dos formas de CV; sin embar-go, se describe una mayor tasa de éxito global para la CVE. En los casos de pacientes con FA menor de 7 días de evolución, la CVE y la CVF tienen una eficacia compara-ble. No se han encontrado diferencias entre ambas modalidades para complicaciones embólicas, por lo cual las mismas medidas de profilaxis antitrombótica de la CVE están indicadas en la CVF.
El principal factor limitante de esta forma de CV son sus complicaciones de tipo proarrítmico. Debido a la presencia de importantes efectos adversos dosis-dependientes, existe una tendencia al mayor uso de la CVE como terapia para recuperar el ritmo sinusal; en la actualidad, este comportamiento aún se conser-va.
Indicaciones de cardioversión farmacológica
En el registro Euro Heart Survey(9) la CVF alcanzó una tasa de éxito del 72 %, identificándose la enfermedad valvular y la FA persistente como los predictores más importantes de fracaso de la CVF.
Figura 1. Elevación transitoria del segmento ST en el ECG, después de cardioversión eléctrica.

233
Fibr
ilaci
ón a
uric
ular
: ind
icac
ione
s de
car
diov
ersi
ón y
pos
terio
r tra
tam
ient
o […
]
Las indicaciones para este tipo de CV no han cambiado en las última guías de tra-tamiento de la FA de la ACC/AHA/ESC 2006(16) (Tabla 3). En general, el tiempo de evolución de la FA, la eficacia y la tolerancia al fármaco elegido son las bases para la indicación de la CVF. Dicha estrategia está indicada en aquellas FA de corta evolución (en especial, dentro de las primeras 48 h) con las mismas medidas de precaución que la CVE. En la mayoría de los casos, requiere la hospitalización del paciente y la moni-torización de posibles efectos colaterales, mucho más frecuentes en las primeras horas y de tipo arrítmico. La CVF extrahospitalaria está restringida para la propafenona y la flecainida en pacientes sin cardiopatía estructural y asociada al uso de fármacos para el control de la FC. Alboni et al. mencionan en su serie de 210 pacientes pos-CVF de FA una tasa de éxito del 94 % en el control de de los síntomas de la arritmia con la autoad-ministración del AA, y hasta un 7 % de efectos adversos después de un seguimiento de 15 meses, en su mayoría no arrítmicos(27).
En aquellos casos de FA con tiempo de evolución mayor de 7 días, y en quienes se deciden por una CVF, los únicos fármacos recomendados son el dofetilide, la amio-darona o el ibutilide(16).
A diferencia de las indicaciones de la CVE, la mayoría de los fármacos empleados en la CVF tienen un nivel de evidencia de tipo A o B.
No es objetivo del presente capítulo realizar una revisión detallada de todas los fár-macos AA, pero consideramos necesario hacer una referencia a aquellas que han demos-trado ser eficaces. Remitimos al lector a la Tabla 4 para conocer las dosis recomendadas y vías de administración; además, con el objetivo de hacer una descripción de los fárma-cos por grupos, nos basaremos en la clasificación modificada de Vaughan Williams:
Amiodarona
• Es más efectiva que el placebo dentro de las primeras 24 horas, pero inferior a fár-macos del tipo IC(28).
• Su eficacia está entre el 55-95 % si se emplean bolos seguidos de una infusión(29).• Es segura en pacientes con cardiopatía estructural.• La tasa de CV a largo plazo (hasta 28 días) llega a alcanzar el 40 %.
Tabla 3. Indicaciones para cardioversión farmacológica en la fibrilación auricular*
IndicaciónNivel de
evidencia
Clase I1. Uso de flecainida, dofetilide, propafenona o ibutilide en
la cardioversión de FA A
Clase IIA1. Uso de amiodarona en forma opcional2. Uso de propafenona o flecainida extrahospitalaria para FA persistente3. Uso de amiodarona para cardioversión no urgente
ACC
Clase III1. El uso de sotalol o digoxina no está indicado A
* Guía de manejo del paciente con fibrilación auricular ACC/AHA/ESC 2006(16).

Arrit
mia
s: m
anej
o pr
áctic
o
234
Tab
la 4
. Fár
mac
os
antia
rrítm
ico
s p
ara
la c
ard
iove
rsió
n y
man
teni
mie
nto
del
ritm
o s
inus
al e
n p
acie
ntes
co
n fi
bri
laci
ón
auri
cula
r
Fárm
acoa
Vía
de
adm
inis
traci
ónCA
RDIO
VERS
IÓN
MAN
TENI
MIE
NTO
DEL
RIT
MO
SIN
USAL
Dosi
sEf
ecto
s ad
vers
osDo
sis
Efec
tos
adve
rsos
Amio
daro
naO
ral
Hosp
.:1,
2-1,
8 g/
día.
Lue
go
200-
400
mg/
día
Extra
hosp
.:60
0-80
0 m
g/dí
a. L
uego
20
0-40
0 m
g/dí
a
Hipo
tens
ión,
bra
dica
rdia
, pr
olon
gaci
ón d
el Q
T, to
rsad
es
de p
oint
es, e
stre
ñim
ient
o,
flebi
tis (i
. v.)
100-
400
mg
Foto
sens
ibilid
ad, t
oxic
idad
pul
mon
ar,
polin
euro
patía
, bra
dica
rdia
, tor
sade
s de
po
inte
s, e
stre
ñim
ient
o, to
xici
dad
hepá
tica,
hip
o/hi
perti
roid
ism
o, d
epós
itos
corn
eale
s
Intra
veno
so/O
ral
5-7
mg/
kg e
n 30
-60
min
Lu
ego
1,2-
1,8
g/dí
a i.
v. u
oral
. Lue
go 2
00-4
00 m
g/dí
a
Dofe
tilid
eO
ral
Corre
gir s
egún
tasa
de
filtr
ació
n gl
omer
ular
Prol
onga
ción
del
QT,
tors
ades
de
poi
ntes
, dos
is a
just
adas
a
func
ión
rena
l, pe
so y
eda
d
500-
1.00
0 μg
Tors
ades
de
poin
tes
Flec
aini
deO
ral/
Intra
veno
so20
0-30
0 m
gb
1,5-
3,0
mg/
kg e
n 10
-20
min
Hipo
tens
ión,
flut
ter a
uric
ular
co
n fre
cuen
cia
vent
ricul
ar a
lta20
0-30
0 m
gTV
, ins
ufici
enci
a ca
rdía
ca, fl
utte
r aur
icul
ar
con
frecu
enci
a ve
ntric
ular
alta
Ibut
ilide
Intra
veno
so1
mg
en 1
0 m
in. S
e pu
ede
repe
tir 1
mg
si e
s ne
cesa
rioPr
olon
gaci
ón d
el Q
T, to
rsad
e de
poi
ntes
Prop
afen
ona
Ora
l/In
trave
noso
600
mg
1,5-
2,0
mg/
kg e
n 10
-20
min
Hipo
tens
ión,
flut
ter a
uric
ular
co
n fre
cuen
cia
vent
ricul
ar a
lta45
0-90
0 m
gTV
, ins
ufici
enci
a ca
rdía
ca, fl
utte
r aur
icul
ar
con
frecu
enci
a ve
ntric
ular
alta
Sota
lol
Ora
l16
0-32
0 m
gTo
rsad
es d
e po
inte
s, in
sufic
ienc
ia c
ardí
aca,
br
adic
ardi
a, e
xace
rbac
ión
de E
POC
a Lo
s fá
rmac
os
se p
rese
ntan
en
ord
en a
lfab
étic
o.
b U
so c
on
rest
ricc
ione
s en
pac
ient
es c
on
enfe
rmed
ad c
oro
nari
a o
insu
ficie
ncia
car
día
ca.
EP
OC
: enf
erm
edad
pul
mo
nar
ob
stru
ctiv
a cr
óni
ca; i
. v.:
intr
aven
oso
.

235
Fibr
ilaci
ón a
uric
ular
: ind
icac
ione
s de
car
diov
ersi
ón y
pos
terio
r tra
tam
ient
o […
]
Dofetilide
• En su presentación oral es más efectiva que placebo en FA con más de una sema-na de evolución y en casos de flutter auricular.
Flecainide
• Es efectiva en FA de reciente inicio con dosis orales de 300 mg, hasta en un 75-91 % dentro de las 8 horas de administración del fármaco(30).
• El efecto por vía intravenosa se alcanza en la primera hora, y por vía oral en 3 pri-meras horas, en la mayoría de casos.
Propafenona
• Es efectiva en la FA de reciente inicio en sus dos formas de presentación. Junto con la flecainida es la droga más eficaz. Aún se discute su eficacia para la CV del flut-ter auricular(31).
Recurrencia precoz y cardioversión facilitada por fármacos
La CVE es una técnica efectiva para restaurar el ritmo sinusal. Sin embargo, su tasa de recurrencia puede llegar al 26 %, en especial, en ausencia de terapia antiarrítmica. Tieleman et al.(32) demostró que la mayor parte de las recurrencias se presentaba den-tro de los primeros 5 días de la CV y los relacionó con un estado de remodelamiento eléctrico y vulnerabilidad de la aurícula debido a la FA, que persistía hasta una sema-na después del procedimiento.
El hecho de proporcionar fármacos AA antes de una CVE tiene como objetivo incrementar la probabilidad de éxito y prevenir la recurrencia de la FA. Los AA dis-minuyen la cantidad de energía requerida, prolongan el período refractario auricular y suprimen la actividad ectópica(33-34).
La administración de AA previos a la CVE logra incrementar la tasa de éxito desde el 72 % hasta cerca del 100 %. Está indicada en pacientes con fracaso pre-vio de la CV y en aquellos con recurrencia inmediata o precoz de la FA, teniendo mayor probabilidad de CV en pacientes jóvenes y con FA de menos de 3 años de evolución(35).
Amiodarona, flecainida, ibutilide, propafenona o sotalol son fármacos que pueden utilizarse para aumentar el éxito de la CVE y disminuir las recurrencias de FA (indica-ción IIA). Algunos fármacos, como la flecainida, pueden presentar un efecto paradóji-co, al incrementar el umbral de desfibrilación en algunos pacientes(34).
Efecto proarrítmico
El principal efecto adverso de los fármacos empleados en la CVF y el mante-nimiento del ritmo sinusal es el efecto proarrítmico. Diversos estudios describen hasta un 13 % de efectos adversos cardíacos, siendo los más frecuentes la bradi-cardia (8 %), prolongación significativa del QT (1,5 %) y arritmias ventriculares

Arrit
mia
s: m
anej
o pr
áctic
o
236
(1,3 %). Un subanálisis del estudio AFFIRM (Atrial Fibrillation Follow-up Inves-tigation of Rhythm Management)(36) reporta una incidencia acumulada de efectos proarrítmicos del 5 %. El riesgo fue mayor en las primeras 24 horas y en pacien-tes con cardiopatía estructural, en especial, disfunción sistólica del VI y enferme-dad coronaria.
La amiodarona es el fármaco con menor efecto proarrítmico cuando se le compara con fármacos del grupo I (OR: 0,28; IC: 0,13-0,59; p < 0,001) y junto con la propafe-nona cuando se los compara frente a placebo(37).
Los fármacos de tipo IC provocan un ensanchamiento del QRS y transtornos de la conducción, al incrementar la duración de la despolarización auricular y ventricular. Esto favorece el enlentecimiento del ciclo de algunas arritmias, como el flutter auricu-lar, provocando una conducción auriculoventricular 1:1 (Figura 2), a veces mal tole-rada por el paciente, por lo que requiere CVE de urgencia. Este efecto no es exclusi-vo de este grupo de fármacos, habiéndose descrito incluso en pacientes que recibían amiodarona(27).
La torsade de pointes es la arritmia ventricular más frecuente en pacientes medi-cados con fármacos que prolongan el QT (Figura 3). Entre los AA, el dofetilide y el sotalol (pertenecientes al grupo III) tienen la mayor incidencia de esta arritmia, ya sea en su uso para CV o a largo plazo(37).
Dentro de las arritmias ventriculares se pueden presentar, además, TV monomórfi-ca (fármacos IC) y TV polimórfica sostenida/FV sin prolongación del QT (fármacos IA, IC y III) (Figura 4).
Se reportan además otros efectos, como la aceleración de la conducción de vías accesorias (digoxina, verapamilo o diltiazem) o bradicardia importante pos-CV, espe-cialmente en pacientes con disfunción del nodo sinusal.
Un factor importante a evaluar en todo paciente que recibe un fármaco antiarrítmi-co es la presencia de transtornos electrolíticos (hipocaliemia y/o hipomagnesemia), los cuales aumentan la predisposición a un efecto adverso.
La selección adecuada e individualizada del fármaco, con dosis corregida a la fun-ción renal y hepática, así como un seguimiento clínico y electrocardiográfico son medi-das obligatorias en toda indicación de fármacos AA en el manejo de la FA.
Figura 2. Flutter auricular con conducción AV 1:1. Paciente con diagnóstico de fibrila-ción auricular y en tratamiento con flecainida oral, quien desarrolla episodio de flutter auricular con ciclo de 400 ms (200 lpm) requiriendo de cardioversión eléctrica.

237
Fibr
ilaci
ón a
uric
ular
: ind
icac
ione
s de
car
diov
ersi
ón y
pos
terio
r tra
tam
ient
o […
]
RITMO SINUSAL Y CONTROL DEL RITMO
La FA es un predictor independiente de mortalidad, está asociada a un riesgo ele-vado de accidente cerebrovascular por cardioembolismo, tiene un riesgo potencial de disfunción ventricular izquierda por taquicardiomiopatía y se acompaña de un dete-rioro importante en la calidad de vida. Restaurar el ritmo sinusal en estos pacien-tes permite disminuir la mortalidad hasta en un 35 % y los riesgos de complicacio-nes embólicas.
Se han diseñado varios estudios para comparar la estrategia de control del ritmo con el control de frecuencia. En la mayoría de éstos no se ha demostrado que el control del ritmo sea superior, en disminuir la mortalidad de los pacientes, a la otra estrategia. Isa et al.(38) realizan un análisis de los cuatro estudios más importantes: PIAF (Pharmaco-logical Intervention in Atrial Fibrillation), AFFIRM(36), RACE(19) y STAF, que en con-junto incluyen poco más de 5.000 pacientes con FA, sin encontrar una diferencia en mortalidad, hospitalización o eventos cardioembólicos. El estudio AFFIRM(36), que incluyó 4.600 pacientes con FA, no encontró diferencia en la mortalidad general (23,8 y 21,3 % en los grupos de control de ritmo y control de frecuencia, respectivamente; p = 0,08). La estrategia de control del ritmo estuvo asociada a una mayor tasa de hos-pitalización y la presencia de efectos adversos de los fármacos.
El objetivo de estos estudios es comparar dos estrategias de tratamiento y no el ritmo sinusal con la FA. Si consideramos que como máximo el 60 % del grupo con control del ritmo alcanzó el ritmo sinusal, diríamos que las estrategias farmacoló-gicas actuales no son las más adecuadas para lograr este objetivo; además, hasta un 50 % de la población real de FA estaría incluida en estos estudios, quedando sin valorar jóvenes con FA aislada y adultos mayores de 80 años, por lo cual, las conclu-
Figura 3. Prolongación del QT secundario al uso de sotalol. Paciente con diagnóstico de fibrilación auricular persistente recurrente y enfermedad coronaria crónica revascula-rizada, en tratamiento con sotalol 160mg /día, en ECG de seguimiento se encuentra QRS de 160 ms y QT de 520 ms que revierten a valores normales luego de suspender el fárma-co (QRS 100 ms y QT 420 ms).

Arrit
mia
s: m
anej
o pr
áctic
o
238
siones de la comparación de ambas estrategias no podrían ser generalizadas a todos los pacientes con FA(39). No es intención de esta revisión defender ninguna de las dos estrategias de tratamiento, pero sí recomendar una decisión terapéutica indivi-dualizada y acorde con la experiencia del médico y del centro tratante.
Indicaciones para mantener el ritmo sinusal
Independientemente de la discusión de cuál de las estrategias es mejor en el manejo de la FA, para la mayoría de los autores existe consenso a la hora de mantener el ritmo sinusal en aquellos pacientes con FA recurrente con síntomas mal tolerados a pesar del control de la frecuencia o con síntomas incapacitantes, y en pacientes con disfunción ventricular izquierda relacionada en forma clara a taquicardiomiopatía. En los casos de FA permanente, se recomienda el control de la FC y sólo si los síntomas no son controlados se asociará al uso de AA u otras estrategias. A diferencia de las guías para el manejo de la FA del año 2001, las actuales no consideran la prevención del remode-lamiento auricular como indicación para conservar el ritmo sinusal.
Además, diferentes estudios en grupos de pacientes seleccionados han encontra-do beneficio en conservar el ritmo sinusal: los adultos mayores con FA tienen un alto riesgo de cardioembolismo y con una importante frecuencia de abandono de la terapia de anticoagulación, éstos se beneficiarían de una terapia combinada con amiodarona y marcapasos para prevenir la recurrencia de FA(40). Asimismo, los pacientes con dis-función ventricular izquierda evaluados en los estudios CHF-STAT (Congestive Heart Failure Survival Trial of Antiarrhythmic Therapy)(41) y DIAMOND (Danish Investi-gation of Arrhythmia and Mortality on Dofetilide)(42) mostraron una disminución en
Figura 4. Taquicardia ventricular polimórfica no asociada a prolongación del QT, en paciente con diagnóstico de fibrilación auricular y en tratamiento con sotalol.

239
Fibr
ilaci
ón a
uric
ular
: ind
icac
ione
s de
car
diov
ersi
ón y
pos
terio
r tra
tam
ient
o […
]
la mortalidad y hospitalización en aquellos que recibieron un antiarrítmico para man-tener el ritmo sinusal.
Se recomienda, como regla general, tratar de encontrar alguna causa reversible de la FA antes de iniciar un tratamiento farmacológico.
Estrategias para mantener el ritmo sinusal
Terapia farmacológica
Fármacos antiarrítmicos
La amiodarona es el fármaco que ha demostrado tener mayor efectividad en con-servar el ritmo sinusal si se la compara con placebo o con fármacos AA del grupo I o sotalol. Es útil en FA persistente o paroxística y, en especial, en pacientes con cardio-patía estructural. En el estudio CTAF (Canadian Trial of Atrial Fibrillation)(43), demos-tró una menor recurrencia de FA frente al grupo tratado con propafenona y sotalol (35 y 63 %, respectivamente; p < 0,001). De igual forma, se demuestra la superioridad de la amiodarona en un subanálisis del estudio AFFIRM(36) y en el estudio SAFE-T (Sotalol Amiodarone Atrial Fibrillation Efficacy Trial)(44). El principal factor limitante de un tratamiento a largo plazo con amiodarona son sus efectos adversos no arrítmi-cos, llegando a un 30 % de suspensión de la terapia.
Además, este fármaco es útil en prevenir la aparición de FA posoperatoria de ciru-gía cardiotorácica y la recurrencia de esta arritmia, en pacientes con cardiomiopatía hipertrófica.
Si se toman las medidas de precaución necesarias y se selecciona a los pacientes, drogas como el dofetilide y el sotalol también han demostrado ser eficaces en mante-ner el ritmo sinusal.
Otros fármacos como la flecainida y la disopiramida no han sido comparados fren-te a la amiodarona y, aunque han demostrado su eficacia, su indicación está supedita-da al fracaso con drogas de primera elección. La decisión sobre qué fármaco antiarrít-mico se debe administrar es individualizada y se basará en la presencia de cardiopatía estructural y en la respuesta del paciente a fármacos previos (seguridad y tolerancia) (Figura 5).
Betabloqueantes como el metropolol, el atenolol y el bisoprolol han demostrado una moderada eficacia en prevenir la recurrencia de la FA o en reducir la FC y los sín-tomas de los episodios paroxísticos, en aquellos casos de FA no mediada por estimu-lación vagal.
Dentro del grupo de las drogas en desarrollo, la dronedarona es la que más expecta-tivas a generado. Se trata de una molécula de estructura similar a la amiodarona, pero sin el componente de yodo, con lo cual no presenta efectos adversos extracardíacos. Es segura y eficaz a dosis de 800 mg/día, y ha demostrado ser también útil en el tra-tamiento del flutter auricular(45). Dos estudios multicéntricos recientes, el EURIDIS (EURopean trial In atrial fibrillation or flutter patients receiving Dronedarone for the maintenance of Sinus rhythm) y el ADONIS (American-Australian trial with Drone-darONe In atrial fibrillation or flutter patients for the maintenance of Sinus rhythm)(46), soportan su seguridad y eficacia, con cerca de 1.200 pacientes tratados. Además, su

Arrit
mia
s: m
anej
o pr
áctic
o
240
utilidad es comparable con la terapia convencional en el control de la FC en pacientes con FA permanente(47), y su potencial beneficio en reducir la mortalidad y hospitaliza-ción por FA se está evaluando en el estudio ATHENA.
Fármacos no antiarrítmicos
La inhibición del sistema renina-angiotensina y la disminución de la inflamación y del proceso oxidativo de la aurícula son los nuevos objetivos para la prevención de la FA(48).
En un reciente metaanálisis(49) tanto los inhibidores de la enzima conversora de la angiotensina (IECA) como los bloqueadores de los receptores de angiotensina (BRA) han demostrado ser altamente efectivos en prevenir la recurrencia de la FA, indepen-dientemente de su efecto antihipertensivo y de la cardiopatía subyacente del pacien-te. Datos del estudio LIFE (Losartan Intervention For Endpoint reduction in hyperten-sión)(50) mostraron que este fármaco redujo hasta en un 33 % la frecuencia de FA de reciente inicio y el riesgo asociado de accidente cerebrovascular, cuando se le comparó con el atenolol. Además, el uso de BRA asociados a AA es una estrategia más efectiva en prevenir la recurrencia de FA que el uso de AA de forma aislada(51).
Otros fármacos como las estatinas y los corticoides a dosis bajas han demostra-do tener efectos antiinflamatorios, disminuyendo los niveles de proteína C reacti-
Mantenimiento del ritmo sinusal
No o cardiopatía mínima
Hipertensiónarterial
Enfermedadcoronaria
Insuficienciacardíaca
Flecainida Propafenona
SotalolHVI
significativaDofetilide
SotalolAmiodarona
Dofetilide
AmiodaronaDofetilide Ablación
AmiodaronaDofetilide
AmiodaronaDofetilide
Amiodarona Ablación
Ablación
Ablación
FlecainidaPropafenona
SotalolAmiodarona
No Sí
Figura 5. Terapia antiarrítmica para mantener el ritmo sinusal en pacientes con fibrila-ción auricular paroxística recurrente o persistente. Los fármacos son listados alfabética-mente. HVI: hipertrofia ventricular izquierda.

241
Fibr
ilaci
ón a
uric
ular
: ind
icac
ione
s de
car
diov
ersi
ón y
pos
terio
r tra
tam
ient
o […
]
va y la recurrencia de FA(52); asimismo, los ácidos grasos poliinsaturados ω3 mos-traron reducir la incidencia de FA posoperatoria cuando se les comparó con sujetos control(53).
Terapia no farmacológica
Estimulación cardíaca
Estrategias como la estimulación auricular estándar, en múltiples sitios de la aurí-cula o desde el ostium del seno coronario, han sido diseñadas para prevenir la apari-ción de la FA; sin embargo, su efectividad aún no está lo suficientemente demostra-da como para justificar su empleo en pacientes que no tengan indicación de implante de un marcapasos.
Los resultados del estudio MOST (MOde Selection Trials in sinus-node dysfunc-tion)(54) en pacientes con disfunción sinusal mostraron que la estimulación ventricu-lar aislada se asociaba a una alta incidencia de FA, por lo cual estos pacientes tendrían indicación de implante de un marcapasos bicameral con algoritmos para minimizar la estimulación ventricular o sólo marcapasos auriculares, a diferencia de aquellos pacientes con bloqueo AV de alto grado, en los que no se observaron diferencias en la incidencia de FA entre los distintos modos de estimulación(55).
Ablación con radiofrecuencia
El tratamiento de la FA con procedimientos de ablación se ha incrementado de for-ma importante en los últimos años, alcanzando para el año 2002 un total aproxima-do de 10.000 pacientes tratados, con un éxito de entre el 70 y el 80 %, según las dife-rentes series (Tabla 5). Se ha evolucionado desde una técnica de ablación focal (en la
Tabla 5. Resultados de la ablación con radiofrecuencia de las venas pulmonares
Estudio AñoN.o
pac.Edad(años)
FA Px(%)
CE(%)
ObjetivoLibre
FA (%)Seguim.
(días)
Serie U. de Arrit. HCSC 2005 89 53 ± 11 79 25 A VPs 73a 480
Ouyang et al. 2004 41 63 ± 9 100 NA A VPs 76b 178
Haissaguerre et al. 2004 70 53 ± 8 NA 43 A VPs 79 210
Mansour et al. 2004 40 55 ± 10 80 13 A VPs 75 330
Marrouche et al. 2003 259 54 ± 11 51 21 A VPs 87 347
Oral et al. 2003 40 54 ± 11 100 3 Electrog. 88 365
Pappone et al. 2003 589 65 ± 9 69 6 Electrog. 79 861
a definido como eliminación de FA. b 95 % de éxito con un segundo procedimiento.A VPs: desconexión de las venas pulmonares; CE: cardiopatía estructural; Electrog.: disminución de voltaje de electrogramas de las venas pulmonares; FA Px: fibrilación auricular paroxística.

Arrit
mia
s: m
anej
o pr
áctic
o
242
aurícula o dentro de las venas pulmonares) a una técnica que incluye la desconexión eléctrica de las VP y/o la modificación de la inervación vegetativa de la aurícula. Aun-que el mayor éxito se obtuvo en pacientes jóvenes, varones, sin cardiopatía avanzada y con FA paroxística; en la actualidad es indicación de segunda línea en pacientes con cardiopatía estructural secundaria a hipertensión, enfermedad coronaria o disfunción sistólica tras el fracaso de por lo menos dos fármacos AA. Incluso un reciente repor-te de Oral et al. en una población con FA crónica demostró que el 74 % de los pacien-tes con ablación de la AI se encontraban libres de recurrencia de FA después de un año de seguimiento, constituyendo un nuevo grupo de potencial beneficio que requie-re mayores estudios(56).
Por ser una técnica invasiva de alta complejidad, no está libre de complicaciones. Así, se reporta la presencia de estenosis de las venas pulmonares hasta en un 3 %, embolismo, taponamiento cardíaco, fístula atrioesofágica y muerte; por lo cual, es un procedimiento que está limitando a algunos centros de alta especialización(57).
En nuestra unidad, durante el período 2004-2005, se han realizado 89 ablaciones por FA, siguiendo una técnica de desconexión eléctrica de las venas pulmonares a nivel ostial y con una tasa de éxito del 73 %, describiendo un 7 % de complicaciones que no han incluido muerte o estenosis severa de las venas pulmonares. Los resultados de la ablación de la FA son dependientes, más que en otras arritmias, de la experien-cia acumulada por el operador, tal como se demostró en el estudio de Alonso et al.(58) realizado en este centro.
BIBLIOGRAFÍA
1. Wolf PA, Abbott RD, Kannel WB: Atrial fibrillation: a major contributor to stroke in the elderly. The Framingham study. Arch Intern Med 1987; 147: 1561-4.
2. Duytschaever M, Haerynck F, Tavernier R, Jordanes L. Factors influencing long term persistence of sinus rhythm after a first electrical cardioversion for atrial fibrillation. Pacing Clin Electrophysiol 1998; 21: 284-7.
3. Van Gelder IC, Crijns HJ. Cardioversion of atrial fibrillation. Pacing Clin Electrophysiol 1997; 20: 2675-83.
4. Abhayaratna W, Seward J, Appleton Ch, Douglas P, Oh J K, Tajik J, et al. Left atrial size: physiologic determinants and clinical aplications. J Am Coll Cardiol 2006; 47: 2357-63.
5. Arribas F. A quién, cuándo y cómo realizar cardioversión. En: Bertomeu V (ed.). Manejo de la fibrilación auricular en el paciente hipertenso. Sociedad Española de Cardiología 2006. p. 17-29. editorial y año?
6. Lown B, Perlroth MG, Kardbey S, Abe T, Harken DE. Cardioversion of atrial fibrillation. N Engl J Med 1963; 269: 325-31.
7. Gallagher MM, Guo XH, Poloniecki JD, Guan Yap Y, Ward D, Camm AJ. Initial energy setting, outcome and efficiency in direct current cardioversion of atrial fibrillation and flutter. J Am Coll Cardiol 2001; 38: 1231.
8. Dittrich HC, Erickson JS, Schneiderman T, et al. Echocardiographic and clinical predictors for outcome of elective cardioversion of atrial fibrillation. Am J Cardiol 1989; 63: 193.
9. Niewlaat R, Capucci A, Camm AJ, Olsson SB, Andersen D, Davis DW, et al. Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation. Eur Heart J 2005; 26 (22): 2422-34.

243
Fibr
ilaci
ón a
uric
ular
: ind
icac
ione
s de
car
diov
ersi
ón y
pos
terio
r tra
tam
ient
o […
]
10. Zipes DP, Fischer J, King RM. Termination of ventricular fibrillation in dogs by depolarizing a critical amount of myocardium. Am J Cardiol 1975; 36: 37-44.
11. Gowda S, Shah A, Steinberg J. Cardioversion of atrial fibrillation. Prog Cardiovas Dis 2005; 48 (2): 88-107.
12. Botto GL, Politi A, Bonini W, Broffoni T, Bonatti R. External cardioversion of atrial fibrillation: role of paddle position on technical efficacy and energy requirements. Heart 1999; 82: 726-30.
13. Kirchhof P, Eckardt L, Loh P, Weber K, Fisher R, Seidl K, et al. Anterior-posterior versus anterior-lateral electrode positions for external cardioversion of atrial fibrillation: a randomized trial. Lancet 2002; 360: 1275-9.
14. Mittal S, Ayati S, Stein KM, Schwartzman D, Cavlovich D, Tchou PJ, et al. Transthoracic cardioversion of atrial fibrillation. Comparison of rectilinear biphasic versus damped sine wave monophasic shocks. Circulation 2000; 101: 1282-7.
15. Alatawi F, Gurevitz O, White R, Ammash N, Malouf J, Bruce Ch, et al. Prospective, randomized comparison of two biphasic waveforms for the efficacy and safety of transthoracic biphasic cardioversion of atrial fibrillation. Heart Rhythm 2005; 2: 382-7.
16. ACC/AHA/ESC Guidelines for the management of patients with atrial fibrillation. Circulation 2006; 114: e257-e354.
17. Nattel S, Opie L. Controversies in atrial fibrillation. Lancet 2006, 367: 262-72.18. Mead G, Eder AT, Flapan AD, Kelman A. Electrical cardioversion for atrial fibrillation and
flutter. The Cochrane Database of Syst Rev 2005; 3: CD002903.19. Hagens VE, Van Veldhuisen DJ, Kamp O, Rienstra M, Bosker HA, Veeger NJ, et al. Rate control
versus rhythm control for patients with persistent atrial fibrillation with mild to moderate heart failure: results from the Rate Control versus Electrical cardioversion (RACE) study. Am Heart J 2005; 149 (6): 1106-11.
20. Opolski G, Torbicki A, Kosior D, Szulc M, Zawadzka M, Pierscinska M, et al. Rhythm control versus rate control in patients with persistent atrial fibrillation. Results of the HOT CAFE Polish Study. Kardiol Pol 2003; 59 (7): 1-16; discussion 15-6.
21. Carlsson J, Miketic S, Windeler J, Cuneo A, Haun S, Micus S, et al. Randomized trial of rate-control versus rhythm-control in persistent atrial fibrillation: the Strategies of Treatment of Atrial Fibrillation (STAF) study. J Am Coll Cardiol 2003; 41: 1690-6.
22. Bjerkelund CJ, Orning OM. The efficacy of anticoagulant therapy in preventing embolism related to D.C. electrical conversion of atrial fibrillation. Am J Cardiol 1969; 23: 208-16.
23. Arnold AZ, Mick MJ, Mazurek RP, Loop FD, Trohman RG. Role of prophylactic anticoagulation for direct current cardioversion in patients with atrial fibrillation or atrial flutter. J Am Coll Cardiol 1992; 19: 851-5.
24. Levine PA. Effect of cardioversion and defibrillation on implanted cardiac pacemakers. En: Barold SS (ed.). Modern Cardiac Pacing. Mount Kisco, NY: Futura; 1985: 875-6.
25. Oakley C, Child A, Luna B, Tornos P, Klein W, Alonso García M, et al. Expert consensus document on management of cardiovascular diseases during pregnancy. European Heart Journal 2003; 24: 774-5.
26. Lukoshevichiute AI. Use of the esophageal electric countershock. Kardiologiia 1978: 18: 12-20.
27. Alboni P, Botto GL, Baldi N, Luzi M, Russo V, Gianfranchi L, et al. Outpatient treatment of recent-onset atrial fibrillation with the “pill-in-the-pocket” approach. N Engl J Med 2004; 351: 2384-91.

Arrit
mia
s: m
anej
o pr
áctic
o
244
28. Chevalier P, Durand-Dubief A, Burri H, Cucherat M, Kirkorian G, Touboul P. Amiodarone versus placebo and classic drugs for cardioversion of recent-onset atrial fibrillation: a meta-analysis. J Am Coll Cardiol 2003; 41: 255-62.
29. Khan IA, Mehta NJ, Gowda RM. Amiodarone for pharmacological cardioversion of recent-onset atrial fibrillation. Int J Cardiol 2003; 89: 239-48.
30. Khan IA. Oral loading single dose flecainide for pharmacological cardioversion of recent-onset atrial fibrillation. Int J Cardiol 2003; 87: 121-8.
31. Khan IA. Single oral loading dose of propafenone for pharmacological cardioversion of recent-onset atrial fibrillation. J Am Coll Cardiol 2001; 37: 542-7.
32. Tieleman RG, Van Gelder IC, Crijns HJ, De Kam PJ, Van Den Berg MP, Haaksma J, et al. Early recurrences of atrial fibrillation after electrical cardioversion: a result of fibrillation-induced electrical remodeling of the atria? J Am Coll Cardiol 1998; 31: 167-73.
33. Shinagawa K, Derakhchan K, Nattel S. Pharmacological prevention of atrial tachycardia induced atrial remodeling as a potential therapeutic strategy. Pacing Clin Electrophysiol 2003; 26: 752- 64.
34. Van Gelder IC, Crijns HJ, Van Gilst WH, Van Wijk LM, Hamer HP, Lie KI. Efficacy and safety of flecainide acetate in the maintenance of sinus rhythm after electrical cardioversion of chronic atrial fibrillation or atrial flutter. Am J Cardiol 1989; 64: 1317-21.
35. Van Gelder IC, Crijns HJ, Tieleman RG, Brugemann J, De Kam PJ, Gosselink AT, et al. Chronic atrial fibrillation. Success of serial cardioversion therapy and safety of oral anicoagulation. Arch Inter Med 1996; 156: 2585-92.
36. Kaufman E, Zimmermann P, Wang T, Dennish G, Barrell P, Chandler M et al. Risk of proarrhythmic events in the atrial fibrillation follow-up investigation of rhythm management (AFFIRM) study. J Am Coll Cardiol 2004; 44: 1276-82.
37. Lafuente C, Mouly S, Longás MA, Mahé I, Bergmann J. Antiarrhythmic drugs for maintaining sinus rhythm after cardioversion of atrial fibrillation. Arch Intern Med 2006; 166: 719-28.
38. Isa R, Pérez-Villacastín J, Pérez-Castellano N, Moreno J, Morales M, Doblado M. A quién, cuándo y cómo mantener el ritmo sinusal. Manejo de la fibrilación auricular en el paciente hipertenso. Sociedad Española de Cardiología; 2006. p. 31-40.
39. Zimetbaum P. Is rate control or rhythm control preferable in patients with atrial fibrillation? An argument for maintenance of sinus rhythm in patients with atrial fibrillation. Circulation 2005; 111: 3150-7.
40. Essbag V, Hadjis T, Paltt R, Pilote L. Amiodarone and the risk of bradyarrhythmia requering permanent pacemaker in elderly patients with atrial fibrillation and prior myocardial infarction. J Am Coll Cardiol 2003; 41: 249-54.
41. Deedwania PC, Singh BN, Ellenbogen K, Fisher S, Fletcher R, Singh SN. Spontaneous conversion and maintenance of sinus rhythm by amiodarone in patients with heart failure and atrial fibrillation: observations from the veterans affairs congestive heart failure survival trial of antiarrhythmic therapy (CHF-STAT). The Department of Veterans Affairs CHF-STAT Investigators. Circulation 1998; 98: 2574-9.
42. Pederson O, Bagger H, Keller N, Marchat B, Kobert L, Torp Pederson C. Efficacy of dofetilide in the treatment of atrial fibrillation-flutter in patients with reduced left ventricular function: a Danish Investigation of Arrhythmia and Mortality on Dofetilide (DIAMOND) study. Circulation 2001; 104: 292-6.
43. Roy D, Talajic M, Dorian P, Connolly S, Eisenberg MJ, Green M, et al. Amiodarone to prevent recurrence of atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators. N Engl J Med 2000; 342 (13): 913-20.

245
Fibr
ilaci
ón a
uric
ular
: ind
icac
ione
s de
car
diov
ersi
ón y
pos
terio
r tra
tam
ient
o […
]
44. Singh B, Singh SN, Reda DJ, Tang XC, López B, Harris CL, et al.; Sotalol Amiodarone Atrial Fibrillation Efficacy Trial (SAFE-T) Investigators. Amiodarone versus sotalol for atrial fibrillation. N Engl J Med 2005; 352 (18): 1861-72.
45. Wegener F, Ehrlich J, Hohnloser S. Dronedarone: an emerging agent with rhythm- and rate-controlling effects. J Cardiovasc Electrophysiol 2006; 17 (Suppl 2): S17-S20.
46. Hohnloser SH. EURIDIS and ADONIS: Maintenance of sinus rhythm with dronedarone in patients with atrial fibrillation or flutter. Abstract presented at the European Society of Cardiology Congress 2004; August 28-September 1, 2004; Munich, Germany.
47. Davy J-M, for the ERATO Investigators: Dronedarone demonstrates additional rate control on top of standard pharmacotherapies in the treatment of atrial fibrillation. Poster presented at the American Heart Association Scientific Sessions; November 15, 2005, Dallas, TX.
48. Lozano H, Conde C, Florín T, Lamas G. Treatment and prevention of atrial fibrillation with nonantiarrhythmic pharmacologic therapy. Heart Rhythm 2005; 2: 1000-7.
49. Healey JS, Baranchuk A, Crystal E, Morillo CA, Garfinkle M, Yusuf S, Connolly SJ. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005; 45: 1832-9.
50. Wachtell K, Lehto M, Gerdts E, Olsen MH, Hornestam B, Dahlof B, et al. Angiotensin II receptor blockade reduces new-onset atrial fibrillation and subsequent stroke compared to atenolol. J Am Coll Cardiol 2005; 45: 712-9.
51. Madrid AH, Bueno MG, Rebollo JM, Marín I, Pena G, Bernal E, et al. Use of irbesartan to maintain sinus rhythm in patients with long-lasting persistent atrial fibrillation. A prospective and randomized study. Circulation 2000; 106: 331-6.
52. Chung MK, Martin DO, Sprecher D, Wazni O, Kanderian A, Carnes CA, et al. C reactive protein elevation in patients with atrial arrhythmias. Circulation 2001; 104: 2886-91.
53. Calo L, Bianconi L, Colivicchi F, Lamberti F, Loricchio ML, De Ruvo E, et al. N-3 fatty acids for the prevention of atrial fibrillation after coronary bypass surgery. J Am Coll Cardiol 2005; 45: 1723-8.
54. Lamas GA, Lee KL, Sweeney MO, Silverman R, Leon A, Yee R, et al. Mode selection trial in sinus-node dysfunction. Ventricular pacing or dual chamber pacing for sinus node dysfunction. N Engl J Med 2002; 346: 1854-62.
55. Toff W, Camm J, Skehan D, Single-chamber versus dual-chamber pacing for high grade atrioventricular block. For the United Kingdom and Cardiovascular Events (UKPACE) Trial Investigators. N Engl Med 2005; 353: 145-55.
56. Oral H, Pappone C, Chugh A, Good E, Bogun F, Pelosi F, et al. Circunferential Pulmonary-Vein Ablation for Chronic Atrial Fibrillation. N Engl J Med 2006; 354: 934-41.
57. Jahangiri M, Weir G, Mandal K, Savelieva I, Camm J. Current strategies in the management of atrial fibrillation. Ann Thorac Surg 2006; 82: 357-64.
58. Alonso R, Pérez-Castellano N, Pérez Villacastín J, Isa R, Ruiz E, Salinas J, et al. Curva de aprendizaje de la ablación de fibrilación auricular. Rev Esp Cardiol 2005; 58 (Supl 1): 48.

Arrit
mia
s: m
anej
o pr
áctic
o
246
ANEXO. Protocolo de cardioversión eléctrica de la Unidad de Arritmias del Hospital Clínico San Carlos
Antes de la cardioversión
Recomendaciones generales
• Evaluación por cardiólogo de la Unidad de Arritmias.• Ayuno durante 6-12 horas previas al procedimiento (electivo).• Firma del consentimiento informado.• Evaluación y consentimiento firmado de anestesiología.
Recomendaciones para el control de la anticoagulación
• Como requisito indispensable, el paciente deberá tener un INR > 2 en los últimos tres controles (3-4 semanas).
• Se realizará ecocardiografía transesofágica (ETE) en todos los casos de FA con tiempo de evolución desconocido o mayor de 48 horas.
• Se realizará ETE en todos los pacientes para ablación de FA, en quienes la anti-coagulación oral será suspendida 72 horas antes y remplazada con heparina de bajo peso molecular hasta 12 horas previas al estudio.*
Durante la cardioversión
• Registro ECG de 12 derivadas.• Asegurar una vía venosa permeable y cuidados de enfermería.• Sedación con propofol, midazolam y/o etomidato, con estrecha vigilancia de la
vía aérea.• CV sincronizada con dispositivo bipolar, con una configuración de las palas ante-
roposterior y con máxima energía en los primeros intentos.
Después de la cardioversión
• Reposo durante dos horas y alta con informe escrito, si no hay complicaciones.• Continuar con esquema de anticoagulación por lo menos durante 3-4 semanas.• Remitir a médico tratante para continuar con manejo y seguimiento.
Ambiente y personal requerido
Ambiente: sala de electrofisiología o unidad coronaria.Personal: médico cardiólogo, médico anestesiólogo y enfermera.
* Dosis: 1 mg/kg de Clexane® cada 12 horas s. c. (máximo 80 mg por dosis).