El contador rápido para encoder “HSC” del S7-1200 - infoPLC.pdf
Informe 2 Hsc Diagrama Equilibrio
-
Upload
jset-estevez -
Category
Documents
-
view
80 -
download
3
Transcript of Informe 2 Hsc Diagrama Equilibrio

APLICACIÓN DEL SOFTWARE HSC PARA OBTENER DIAGRAMAS DE COMPOSICIONES DE SISTEMAS ACUOSOS EN EQUILIBRIO
PRESENTADO POR:
REINALDO VARGAS RODRIGUEZ JESUS EDUARDO GONZALES ACEVEDO
PRESENTADO A:
JESUS A. DELGADO M. INGENIERO METALÚRGICO
UNIVERSIDAD INDUSTRIAL DE SANTANDER – UIS ESCUELA DE INGENIERIA METALURGICA Y CIENCIA DE MATERIALES
LABORATORIO HIDROMETALURGIA Y ELECTROMETALURGIA BUCARAMANGA, II SEMESTRES DE 2012

1. OBJETIVOS
Obtener y analizar con ayuda del Software HSC diagramas de composición en equilibrio de sistemas acuosos.
Analizar los diagramas de composición en equilibrio de sistemas acuosos variando ciertas condiciones.
2. DIAGRAMA DE FLUJO DEL PROCEDIMIENTO SEGUIDO EN LA PRACTICA REALIZADA

3. GRAFICAS, ANALISIS Y SOLUCION DE PREGUNTAS FORMULADAS.
SISTEMA No. 1 - Ag-NaCl-H2O
- Reacciones que tienen lugar en un proceso de precipitación de iones Ag+ por adición de NaCl.
(Agua) (Ion Hidrogeno (+)) (Ion Hidróxido (-))
(Cloruro de Sodio) (Ion Sodio (+)) (Ion Cloro (-))
(Ion Plata (+)) (Ion Cloro (-)) (Cloruro de Plata)
- GRAFICAS SISTEMA NO. 1 – Ag-NaCl-H20
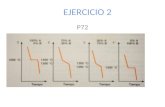
Grafica 1. Sistema con 1 Kmol de Ag (+), 0.1 Kmol de NaCl – step de 0.05, Agua 3Kmol Agua.
De la gráfica 1, podemos deducir que la formación de Cloruro de Plata (AgCl) depende de la cantidad de Iones Ag (+a) que se encuentren en el sistema. Después

de combinarse la totalidad de los iones Ag (+a) presentes en el sistema, el cloruro de sodio (NaCl) disminuye su capacidad de disociación. Obteniendo cloruro de Sodio (NaCl) solido en la solución.
Grafica 2. Sistema con 0.5 Kmol de Ag (+), 0.1 Kmol de NaCl – step de 0.05, Agua 3Kmol Agua.
De la gráfica 2, podemos apreciar el mismo comportamiento que la solución en la gráfica 1, en donde la formación de Cloruro de Plata (AgCl) depende de la cantidad de iones plata (Ag+). Además, podemos observar que la cantidad inicial de Ag(+) reacciona instantáneamente en AgCl por ello inician en cantidades de 0,4Kmol y 0,1Kmol respectivamente.
Grafica 3. Sistema con 1.5 Kmol de Ag (+), 0.1 Kmol de NaCl – step de 0.05, Agua 3Kmol Agua.

De la Grafica 3, podemos observar que en la solución final permanecen Iones Plata (Ag +), debido a que la cantidad de Cloruro de Sodio (NaCl) no es la suficiente para formar Cloruro de Plata (AgCl). Lo anterior, debido a que el software realiza 21 iteraciones y el paso definido (step) es de 0,05 y la cantidad de NaCl a simular es solo de 1.1 Kmol.
Grafica 4. Sistema con 1.0 Kmol de Ag (+), 0.5 Kmol de NaCl – step de 0.05, Agua 3Kmol Agua.
De la Grafica 4, observamos el mismo comportamiento descrito en las gráficas anteriores, donde la cantidad de AgCl que se forma es debido a la relación inversamente proporcional entre el ion Ag+ y el Cloruro de Sodio (NaCl). Para este caso, la cantidad inicial de NaCl aumento (0,5Kmol) por lo tanto la cantidad inicial de Ag(+) inicia en 0,5, ya que el otro 0,5 ya se transformó en AgCl.
Grafica 5. Sistema con 1.0 Kmol de Ag (+), 0.01 Kmol de NaCl – step de 0.05, Agua
3Kmol Agua.

De la gráfica 5, podemos observar la relación inversamente proporcional entre los iones plata (Ag+) y el cloruro de Sodio (NaCl). En la solución no hay presencia de Iones Cloro (Cl - ) debido a que se une con los iones Plata (Ag +) para formar NaCl. Los iones Na + como no tienen con quien reaccionar permanecen en la solución final. Al modificar el step de la solución, la gráfica se reduce o se amplía en el eje horizontal, eje donde se observa la cantidad de NaCl que se adiciona a la solución. En la gráfica 6 se utilizó un step más pequeño, por ello la cantidad de NaCl simulado alcanza a 0,30Kmol que corresponde también a la cantidad final de iones Na+ y AgCl (Directamente ligados al NaCl, ya que los Iones plata (Ag +) se encuentran en exceso para este caso.
Grafica 6. Sistema con 1.0 Kmol de Ag (+), 0.1 Kmol de NaCl – step de 0.01, Agua
3Kmol Agua.
En la Grafica 7, la cantidad de NaCl se simula en Exceso. Observándose que la disolución del NaCl en presencia de Iones Plata (Ag+) es mayor, que después de la formación del Cloruro de Plata (AgCl).

Grafica 7. Sistema con 1.0 Kmol de Ag (+), 0.1 Kmol de NaCl – step de 0.5, Agua 3Kmol Agua.
SISTEMA No. 2 - Ba-Sr-Na2SO4-H2O
- Reacciones que tienen lugar en un proceso de precipitación de iones Ba++ y Sr++ por adición de Na2SO4.
(Agua) (Ion Hidrogeno (+)) (Ion Hidróxido (-))
(Sulfato de Sodio) (Ion Sodio (+)) (Ion Sulfato (-2))
(Ion Bario (+2)) (Ion Sulfato (-2)) (Sulfato de Bario)
(Ion Estroncio (+2)) (Ion Sulfato (-2)) (Sulfato de Estroncio)

- GRAFICAS SISTEMA NO. 2 – Ba-Sr-Na2SO4-H2O
Grafica 8. Sistema con 1.0 Kmol de Ba (+2), 1.0 Kmol de Sr (+2), 0.1 Kmol de Na2SO4 – step de 0.1, Agua 3Kmol Agua.
Grafica 9. Sistema con 0.5 Kmol de Ba (+2), 1.2 Kmol de Sr (+2), 0.1 Kmol de Na2SO4 – step de 0.1, Agua 3Kmol Agua.

Grafica 10. Sistema con 1.2 Kmol de Ba (+2), 0.5 Kmol de Sr (+2), 0.1 Kmol de Na2SO4 – step de 0.1, Agua 3Kmol Agua.
Grafica 11. Sistema con 1.0 Kmol de Ba (+2), 1.0 Kmol de Sr (+2), 0.8 Kmol de Na2SO4 – step de 0.1, Agua 3Kmol Agua.

Grafica 12. Sistema con 1.0 Kmol de Ba (+2), 1.0 Kmol de Sr (+2), 0.05 Kmol de Na2SO4 – step de 0.1, Agua 3Kmol Agua.
Grafica 13. Sistema con 1.0 Kmol de Ba (+2), 1.0 Kmol de Sr (+2), 0.1 Kmol de Na2SO4 – step de 0.5, Agua 3Kmol Agua.
Grafica 14. Sistema con 1.0 Kmol de Ba (+2), 1.0 Kmol de Sr (+2), 0.1 Kmol de
Na2SO4 – step de 0.01, Agua 3Kmol Agua.

De las anteriores graficas (8 – 14), podemos deducir que el sulfato de sodio (Na2SO4) se disocia tan solo en presencia de iones bario (Ba +2) y/o iones Estroncio (Sr +2) en Iones sodio (Na+) y iones Sulfato (SO4 -). Los iones sulfato (SO4 -) en solución presentan mayor afinidad por los iones bario (Ba +2) que por los iones Estroncio (Sr +2) independientemente de las cantidades agregadas. Las especies que se presentan en la solución final serán Iones Sodio (Na +) que no reaccionan con ninguna otra especie, Sulfato de Bario (BaSO4), Sulfato de Estroncio (SrSO4) y Sulfato de Sodio (Na2SO4). Cabe aclara, que las cantidades de las sustancias anteriores dependerán de las cantidades de Iones Bario, Iones Estroncio y Sulfato de Sodio agregadas.

4. CONCLUSIONES
La utilización del software HSC para la obtención de graficas de equilibrio, las
cuales son una herramienta muy útil para analizar y predecir sucesos que
ocurran en una planta real, cabe resaltar que esto es una ayuda teórica y no
siempre se ajustara 100 % a la realidad, por lo cual se debe estar muy pendiente.
Los diagramas permiten predecir resultados, modificando las variables, sin tener
que realizar experimentos, que en algunos casos podrían ser costosos y tener
cierto grado de dificultad que podrían modificar los resultados. También ayuda
a obtener los valores teóricos óptimos para llevar a cabo la precipitación de cierta
cantidad de algún ion de interés, sin gastar los reactivos excesivamente.
Aunque en la realidad existen formaciones de iones complejos los diagramas
facilitan el entendimiento de los sucesos que le ocurren a cada una de las
especies, pero su mayor desventaja es que estos gráficos son realizados en base a
cálculos termodinámicos, lo que no permite conocer el tiempo que se requiere
para llevarse a cabo todas estas reacciones. Y en la industria una de las variables
más importantes es el tiempo, por lo cual no se debe seguir completamente lo
que en los diagramas se indica.
5. BIBLIOGRAFÍA
(1) Manual HSC CHEMISTRY FOR WINDOWS. Chemical Reaction and equilibrium software with extensive thermochemical database. Version 4.0. 1999