Tumor neuroendocrino-pulmonar-maligno-1203109800724194-2 (pp tshare)
LAB 2B (2012) - SISTEMA NEUROENDOCRINO EN INSECTOS (estudiantes).doc
-
Upload
alma-arrieta -
Category
Documents
-
view
226 -
download
5
Transcript of LAB 2B (2012) - SISTEMA NEUROENDOCRINO EN INSECTOS (estudiantes).doc

Con la finalidad de mantener la homeostasis corporal, los organismos multicelulares, utilizan distintas vías y mecanismos que permitan la comunicación intercelular mas allá de un contacto directo. En general, estos mecanismos están mediados por mensajeros químicos liberados por la acción coordinada e integrada del sistema nervioso y el sistema hormonal. Ambos sistemas cumplen funciones de control y regulación en una amplia variedad de procesos fisiológicos incluyendo embriogénesis, desarrollo, balance de agua, metabolismo, polimorfismo, cópula, reproducción, comportamiento, determinación de casta social y diapausa; entre otros.El sistema nervioso y endocrino difieren en muchos aspectos relacionados con el mensajero liberado, el tiempo y duración del efecto y la distancia entre el sitio de liberación y la célula blanco. Mientras el sistema nervioso es capaz de producir mensajeros químicos (neurotransmisores, neuromoduladores) en forma rápida, el alcance del mensaje está limitado por el gasto energético y cantidad de volumen de tejido que representaría una red de nervios haciendo contacto con cada célula y así regular sus funciones a corto y largo plazo. Sin embargo, el sistema endocrino representa una vía muy eficiente de regular funciones celulares en forma sostenida y en varios tipos celulares localizados muy distantes entre sí. La integración y coordinación entre ambos sistemas se produce gracias a la actuación de un tipo de neuronas especializadas que producen y liberan mensajeros químicos hacia el sistema circulatorio, pudiendo afectar distintas tejidos blanco distantes (neurohormonas).
En fisiología animal uno de las áreas mas extensamente estudiadas se relaciona con la descripción de los mecanismos y vías de control neural y endocrino que participan en el desarrollo y crecimiento del organismo. En particular, los mecanismos de morfogénesis han sido extensamente investigados utilizando los insectos como modelo animal experimental, debido fundamentalmente a que su morfología es determinada casi enteramente por la presencia de la cutícula. Así las hormonas deben actuar principalmente en las células de la epidermis para producir una característica específica en cualquier estadío del ciclo de vida. Por otra parte, los artrópodos, en particular los organismos agrupados como holometábolos, se caracterizan por mostrar ciclos de vida fuertemente metamórficos con reorganización drástica corporal durante la etapa de pupa. Finalmente, el control biológico del crecimiento y reproducción de estos organismos tiene fuerte repercusiones en muchos aspectos de la salud humana.
Los primeros experimentos que demostraron la participación de un sistema neuroendocrino en la morfogénesis en insectos, fueron realizados entre 1917 y 1922 por Stefan Kopec, quien encontró que si aislaba mecánicamente (mediante una atadura) segmentos específicos de larvas de Lymantria dispar (polilla), la larva sólo pasaría a pupa en los segmentos antes de la atadura, mientras los segmentos posteriores permanecían en estado larval. Estos resultados variaban dependiendo del nivel donde se realiza la atadura (numero de segmento) y el estadio en que se encontraba la larva previo a la realización.
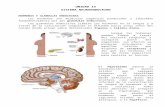
Las principales hormonas y neurohomonas funcionalmente involucradas en el desarrollo posembriónico de insectos pertenecen al grupos de los esteroides (ecdisona), sesquiterpenos (hormona juvenil) y varias hormonas peptídicas. Las diferentes hormonas son producidas tanto en el sistema nervioso central como en glándulas u órganos torácicos y poseen diferentes mecanismos de señalización (figura 1).
1
PRACTICA 4REGULACION
HORMONAL DE LA MORFOGENESIS

Figura 1: Control en el ciclo de muda en insectos, con la participación de múltiples asa de regulación entre diferentes hormonas. El eje principal que involucra las hormonas protoracicotropica (PTTH), Ecdisona (ECD) y hormona juvenil (JH) esta señalizada con flechas gruesas, mientras las rutas de retrocontrol (regulación) se muestran como lineas interrumpidas. Las otras hormonas, probablemente no están presentes en todos los insectos.
La hormona ecdisona (producida por la glándula protorácica) programa a la célula hacia la metamorfosis y regula todos los eventos involucrados con la muda. La tasa de formación de la pupa y estructuras adultas es mediada por la acción de la hormona juvenil, producida y almacenada en la corpora allata). JH mantiene efectivamente la cuticula del animal (y la morfología) en su forma juvenil. La orquestación final de otro grupo de hormonas son responsables de múltiples aspectos de la metamorfosis tal como inmovilización, retracción de los segmentos anteriores y oscurecimiento de la cutícula. Así mismo, existe una múltiples vías de retrocontrol que permite regular los niveles de JH por neuropéptidos (alatostatina y alatotropina) y por señal neural directa (posiblemente glutaminérgica) hacia la corpora allata. Los niveles de ecdisona en la hemolinfa son reguladas por la hormona protoracictrópica (PTTH) secretada [por células neurosecretoras en el cerebro y almacenada en la corpora cardiaca. La secreción de PTTH es regulada por factores ambientales (intensidad de la luz, fotoperiodo, temperatura, disponibilidad de alimento y posiblemente, tamaño poblacional. Ecdisona ejerce un retrocontrol recíproco hacia el cerebro que regula los niveles de JH. Estos niveles de control fino pero complejo, son cruciales en la progresión de la metamorfosis rápidamente y de modo ordenado
I.- OBJETIVOS.Identificar los principales órganos neurosecretoras y hormonales en larvas de alguna clase de insectos para conocer su la organización y localización
Realizar un experimento simple (“ligamiento”) para comprender el modo de acción de hormonas de insectos
2

II.- MATERIALES.Material biológico Cultivo de larvas del género Anastrepha, (Dipteran) en distintos estadíos (2do y
3er instar) Larvas de Heraclides anchisiades
Equipo e instrumentos Hilo de algodón encerado o hilo dental Tijeras pequeñas de disección Pinzas finas de disección Espátulas de madera o metal Papel toalla Cajas de petri vacías Caja de petri con disco de papel de filtro. Cajas de petri con agar en jugo de manzana
III. PROCEDIMIENTO.Experimento 1: Identificación del sistema neuroendocrino de insectos.
En el laboratorio encontrará de larvas de Anatrepha spp (3er Instar) y/o una especie de mariposa. Escoja realizar la disección del sistema neuroendocrino de una de ésta preparaciones.
1. Realice la disección del sistema neuroendocrino del espécimen escogido (mosca o mariposa). Puede orientarse observando las figuras que se muestran al final de la práctica
2. Usando el estereoscopio, haga un esquema de sus observaciones e identifique las siguientes estructuras:Cerebro, Ganglio subesofageal, Corpora cardiaca, Corpora allata, Glándulas prototorácicasGanglios torácicos, Ganglios Abdominales Haga una descripción del sistema nervioso/endocrino de la preparación escogida.
Mencione la función general de cada una de sus componentes.
3

3. Observe el siguiente diagrama e identifica los componentes de un sistema neuroendocrino.
Neurohormona; Neurotransmisor; Neuromodulador; Célula endocrina; órgano neurohemal; Hormona; Célula neurosecretora
(A)
(B)
4
Neurona 1Neurona 2
Neurona 3
A
BC
D
EF
Célula blanco
HG
Efecto biológico
Efecto biológico

(C) (D)(E) (F)(G) (H)
Experimento II. Ejecución de un experimento sencillo de ligamiento para demostración del “Periodo Crítico Cerebral” (PCC).
Para iniciar la muda desde el estado larva a pupa, el cerebro del insecto debe estar presente antes y durante este periodo. Este lapso de tiempo se denomina un “Periodo Crítico Cerebral” (PCC). Durante éste tiempo se liberan un grupo de hormonas que controlan la morfogénesis y muda del individuo.
En el siguiente ejercicio, se aislará mecánicamente los compartimientos torácicos y abdominales en larvas de Anastrepha spp. impidiendo la libre circulación de factores morfogénicos entre los segmentos aisladosSe utilizarán 45 larvas de Anastrepha spp en distintos estadíos del 2do y 3er instar (15 en cada estadio) además de un único grupo control. La metodología consiste en el aislamiento mecánico de 2 regiones de la larva, realizando una atadura firme alrededor entre el quinto y sexto segmento visible (abdominal). De esta manera el cuerpo de la larva quedará subdividido en 2 compartimientos: un compartimiento anterior (cefálico y torácico) que contiene la glándula anular (1 en la figura 3); y un compartimiento abdominal (2 en la figura 3)
Nota importanteLos grupos de trabajo deben organizarse de forma de que puedan iniciar el experimento el miércoles previo a la sesión de laboratorio a las 7 am y finalizar el procedimiento no mas tarde de las 10 am de ese mismo miércoles. Posteriormente, cada grupo deben registrar sus observaciones en periodos de 8 horas, 12 horas, 24 horas 30 y y 48 horas posterior a la realización de la atadura.
1. En el mesón encontrará un cultivo de larvas de anastrepha spp. entre el 2do y 3er instar
2. Cuidadosamente tome distintas larvas e individualmente identifique aquellas que se encuentren en el 2do instar y 3er instar larval temprano o tardío
Breve descripción de la larva de Anastrepha spp: El estadío larval comprende 3 instar que pueden ser diferenciado por tamaño, características morfológicas en la cabeza,
5
Figura 2: representación de una larva de Anastrepha spp., mostrando la localización de la atadura que se debe realizar en este experimento
1
2
3er instar
Figura 3: Características morfológicas de las larvas de Anastrepha spp en 2do y 3er instar
2do instar
a
b

segmentos protorácicos, incluyendo los ganchos bucales, espiráculos anteriores y varios tipos de órganos sensoriales. Cada instar se compone de 11 segmentos torácico-abdominales que no se distinguen fácilmente (figura 4a). En el 2do estadío (figura 4b), la coloración de la larva es blanco-crema pálido, se observa el extremo anterior bien desarrollado que incluye espiráculos anteriores, y gancho bucales negros. La larva en el 3er instar es de apariencia crema-amarillenta pálida, en forma cilíndrica, con extremo posterior aplanado con morfología anterior muy bien definida. Los ganchos bucales consisten de un par de dientes de puntas muy finas y fuertemente esclerotizados. Dos espiráculos pequeños y ligeramente asimétrico, se localizan lateralmente en la base del 1er segmento corporal detrás de la cabeza, se origina a partir de modificaciones de la traquea que se divide en pequeños túbulos. Los segmentos caudales tienen también un par de espiráculos. Las larvas en el 3er instar tardío (justo antes de alcanzar el estadío de prepupa) vacían completamente el intestino. A simple vista se reconoce esta etapa por la ausencia de una línea oscura que se observa en la mitad del cuerpo, producto del alimento que está siendo digerido. Esta línea es muy marcada en larvas más tempranas del desarrollo
3. Prepare 3 grupos experimentales de larvas colocando en cada grupo, 10 individuos con la siguiente distribución:
(i) grupo 1: larvas en el 2do instar
(ii) grupo 2: larvas en el 3er instar temprano
(iii) grupo 3: larvas en el 3er instar tardío
4. Realice el experimento de ligamiento siguiendo el procedimiento descrito a continuación en cada una de las 15 larvas de los grupos 1, 2 y 3
4.1) Utilizando un par de pinzas prepare dos bucles flojos de un nudo simple, como se muestra en la figura.
4.2) Localice el primer y segundo segmento abdominal de la larva
4.3) Coloque una de las larvas en una cama fría (caja de petri en hielo) por un período entre 15 – 30 min.
4.4) Localice el primer y segundo segmento abdominal de la larva y coloque el asa en la posición donde harás el ligamiento en la larva.
4.5) Hale firmemente los terminales del hilo con cuidado de no halar muy fuertemente. El nudo debe ser firme pero sin impedir la retracción o protracción de las parte bucales de la larva.
(ver figura)4.6) Una los terminales libre con otro nudo.
4.7) Corta cuidadosamente los terminales libres que sobren.
4.8) Retorne la larva ligada a la caja experimental (caja de petri) que tiene en el fondo un disco de papel de filtro humedecido.
6

7
Figura 4: (a) Representación de la morfología interna de dipteran, (b) Esquema de los componentes del sistema neuroendocrino de una larva de lepidóptera, que muestra la localización de la corpora allata en relación a la corpora cardíaca, el cerebro y el ganglio subesofageal, así como las conexiones de nervios entre estas estructura; cc = corpora cardiaca, con s = conectivo suboesofageal, con th = conectivo del tórax , nas = nervio allatosuboesophagealis, nca = nervio corporis allati, ncc I–IV = nervio corporis cardiaci, nsc lat, cél. neurosecretores (nsc) laterales del protocerebro, nsc sub = nsc del ganglio subesofageal, nsc trit = nsc del tritocerebro, ol =lóbulo óptico, protoc = protocerebro, sg = ganglio subesofageal, trit = tritocerebro (from Sláma K, Romaňuk M, šorm F (1974) Insect hormones and bioanalogues. Springer-Verlag, New York).
a b

ANALISIS DE RESULTADOS 5. Para cada uno de los grupos experimentales y el control, se debe estimar el porcentaje
(%) de formación de pupa para cada compartimiento y el índice o grado del pupario (ver punto 6), en periodos entre 8 hrs, 12, 24, 30 y 48 horas de realizado la atadura. Así, los integrantes de cada grupo deben coordinarse para que las medidas sean realizadas en el tiempo estipulado y manteniendo los mismos criterios de observación a lo largo del experimento
Igualmente importante es cuantificar el % de mortalidad de larvas para cada periodo observado
6. El grado de oscurecimiento de la pupa (índice del pupario) en respuesta a la atadura en los distintos estadios de la larva, puede ser estimado siguiendo un método similar al que se muestra en la figura 3ª y 3b. Se utiliza una escala de 100%, 75%, 50%, 25% y 0% para designar el grado de oscurecimiento de la cutícula con 0% (0) para larvas que no presentan oscurecimiento de la cutícula y 100% en aquellos compartimiento de la larva con oscurecimiento profundo
Aspectos que debe incluir en el reporte Breve introducción a cerca de la regulación neuroendocrina en insectos. Objetivos.
Predicciones. Metodología
Diseñar un cuadro de los resultados obtenidos que permita conocer, para cada una de los grupos experimentales (2do instar, 3er instar temprano y 3er instar tardío) y el control
Numero de individuos,Número de sobrevivientesPorcentaje de individuos que mostraron pupación en abdomen y tórax (en cada tiempo de medida)Índice de pupación en abdomen y toráx (en cada tiempo de medida)
Con estos datos haga una gráfica donde establezca la relación entre el grado de pupación de los compartimientos anterior y posterior de la larva de Anastrepha spp en función del tiempo
En el mismo gráfico, exprese el porcentaje de mortalidad
En base a los resultados del grupo control, ¿que puede deducir del ciclo de vida de la mosca Anastrepha spp?
Describa extensamente sus resultados. Incluya en la descripción si observó diferencias en la incidencia de pupación entre compartimientos en el tiempo, entre los grupos experimentales y con respecto al control. Mencione si observó diferencias en el tiempo de formación de pupario entre los grupos experimentales con respecto al grupo control.¿Coinciden estos resultados con sus predicciones?
8
Figura 5: (a) representación del índice de pupación (b) fotografías mostrando los cambios de coloración observados en larvas de Anastrepha previamente ligadas

En base a algún reporte sobre los cambios temporales en la concentración de las neurohormonas/hormonas durante el ciclo de vida en dípteros, ¿como podría explicar sus resultados?
Diseñe algún experimento cuyo resultados le permita confirmar la explicación dada en el punto anterior
No olvide las referencias bibliográficas que consultó.
Fecha de entrega: martes 11/09 (grupo B) o martes 18/09 (grupo A), al finalizar la clase teórica
Recuerden entregar una copia de sus datos al grupo de discusión
9